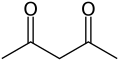
Acetyloaceton
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C5H8O2 | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
(CH3CO)2CH2 | ||||||||||||||||||||||||||||||||||||||||
| Masa molowa |
100,12 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna lub jasnożółta, łatwopalna ciecz[1] | ||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
Acetyloaceton, 2,4-pentanodion – organiczny związek chemiczny z grupy ketonów, pochodna acetonu, najprostszy β-diketon (związek posiadający dwie grupy ketonowe rozdzielone jednym atomem).
Właściwości
W temperaturze pokojowej jest to bezbarwna ciecz o charakterystycznym, ostrym zapachu. Jako typowy β-diketon, 2,4-pentanodion ulega tautomerii ketonowo-enolowej:
Jego enolan jest używany jako odczynnik kompleksujący o skrócie acac.
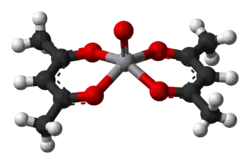
Chemia koordynacyjna
2
Anion acetyloacetonu tworzy związki kompleksowe z wieloma jonami metali przejściowych. Główną metodą syntezy jest reakcja jonu metalu z acetyloacetonem w obecności zasady (B):
- Mz+
+ z(acacH) + zB ⇌ M(acac)
z + zBH+
która pomaga w usuwaniu protonu z acetyloacetonu i przesuwa równowagę na korzyść kompleksu. Oba atomy tlenu wiążą się z metalem tworząc pierścień sześcioczłonowy. W niektórych przypadkach wiązanie jest tak silne, że dodanie zasady nie jest potrzebne do wytworzenia kompleksu. Ze względu na to, że kompleks metalu nie ma ładunku elektrycznego, jest on rozpuszczalny w niepolarnych rozpuszczalnikach organicznych[10].
Uwagi
Przypisy
- 1 2 3 Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- 1 2 3 4 5 6 Haynes 2016 ↓, s. 3-438.
- 1 2 Haynes 2016 ↓, s. 5-160.
- 1 2 3 4 5 6 7 8 9 Pentane-2,4-dione, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 030800 [dostęp 2018-07-30] (niem. • ang.).
- ↑ Małgorzata Galus, Tablice chemiczne, Warszawa: Wydawnictwo Adamantan, 2008, s. 170–171, ISBN 978-83-7350-105-8.
- 1 2 3 Haynes 2016 ↓, s. 16-28.
- ↑ Haynes 2016 ↓, s. 9-64.
- ↑ Acetyloaceton (nr 05581) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2018-07-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Acetylacetone (nr 05581) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2018-07-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Katherine H. Thompson, Chris Orvig, Coordination chemistry of vanadium in metallopharmaceutical candidate compounds, „Coordination Chemistry Reviews”, 219–221, 2001, s. 1033–1053, DOI: 10.1016/S0010-8545(01)00395-2 (ang.).
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).