Dekasiarczek tetrafosforu
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny |
P4S10 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
P | ||||||||||||||||||||||
| Masa molowa |
444,50 g/mol | ||||||||||||||||||||||
| Wygląd |
żółte kryształy[1] | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
Dekasiarczek tetrafosforu, pentasiarczek difosforu, nazwa Stocka: siarczek fosforu(V) – nieorganiczny związek chemiczny z grupy siarczków, połączenie fosforu i siarki.
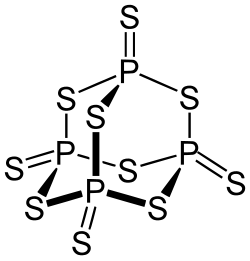
Budowa cząsteczki
Posiada tetraedralną strukturę molekularną podobną do adamantanu i niemalże identyczną ze strukturą dekatlenku tetrafosforu[3].
Otrzymywanie
Skala przemysłowa
Metoda syntezy wykorzystywana w przemyśle polega na bezpośredniej reakcji fosforu białego (P
4) z siarką w atmosferze CO
2 w wysokiej temperaturze[4][5]. Po raz pierwszy P
2S
5 został otrzymany właśnie tym sposobem przez Berzeliusa w 1843 roku[4].
Skala laboratoryjna
P
4S
10 może być także otrzymany poprzez podgrzewanie difosforku żelaza z pirytem lub siarką[4]:
- 4Fe
2P + 18S → P
4S
10 + 8FeS - 4Fe
2P + 18FeS
2 → P
4S
10 + 26FeS
Właściwości
Właściwości fizyczne
P
4S
10 rozpuszcza się w CS
2 i wodnych roztworach wodorotlenków alkalicznych[1][6]. Częściowo rozpuszczalny w eterach, związkach aromatycznych i aminach trzeciorzędowych[1]. Silnie higroskopijny[6].
Właściwości chemiczne
Reaguje z wieloma rozpuszczalnikami, m.in. z wodą, DMSO, alkoholami, aminami pierwszo- i drugorzędowymi[1]. W reakcji z wodą powstają kwas fosforowy i siarkowodór, który odpowiada za zapach zgniłych jaj towarzyszący P
4S
10[7]:
- P
4S
10 + 16H
2O → 4H
3PO
4 + 10H
2S↑
Łatwopalny, rozkłada się na wolnym powietrzu do dwutlenku siarki i dekatlenku tetrafosforu[6]:
- P
4S
10 + 15O
2 → P
4O
10 + 10SO
2↑
Wykorzystywany w reakcjach siarkowania (wymiany atomu tlenu na atom siarki). W roli tej coraz częściej zastępowany jest przez swoją pochodną, odczynnik Lawessona[8], który otrzymuje się poprzez podgrzewanie anizolu z P
4S
10[9]. Reaguje z pirydyną, tworząc kompleks P
4S
10(py)
4, również wykorzystywany w reakcjach siarkowania[10]
Zastosowanie
Rocznie produkuje się około 150 tys. ton P
4S
10[11]. Jest wykorzystywany głównie w syntezie estrów dialkilowych lub diarylowych kwasu ditiofosforowego ((RO)
2P(S)SH i (ArO)
2P(S)SH), które – w postaci soli cynkowych ([(RO)
2PS
2]
2Zn) – stanowią dodatki do smarów i olejów silnikowych[11][12][13]. Wchodzi w skład odczynnika Nokesa, wykorzystywanego jako środek flotacyjny w procesie wzbogacania rudy molibdenu – molibdenitu[14]. Wykorzystywany jest również w produkcji pestycydów fosforanoorganicznych[11], takich jak Paration[15] i Malation[16].
Przypisy
- 1 2 3 4 5 6 7 8 Scott D. Edmondson, Mousumi Sannigrahi, Phosphorus(V) Sulfide, [w:] Encyclopedia of Reagents for Organic Synthesis, Chichester, UK: John Wiley & Sons, Ltd, 15 października 2004, DOI: 10.1002/047084289x.rp166s.pub2, ISBN 978-0-471-93623-7 [dostęp 2024-10-27] (ang.).
- 1 2 3 4 Phosphorus pentasulfide 1314-80-3 [online], ChemicalBook [dostęp 2024-10-27] (ang.).
- ↑ Corbridge 1995 ↓, s. 113.
- 1 2 3 Corbridge 1995 ↓, s. 117.
- ↑ Preparation method of phosphorus pentasulfide, patent CN 101844755B, 29 czerwca 2011 [dostęp 2024-10-26] (ang.).
- 1 2 3 Phosphorus Pentasulfide, [w:] Richard J. Lewis (red.), Hawley's Condensed Chemical Dictionary, Wiley, 15 marca 2007, s. 986, DOI: 10.1002/9780470114735.hawley12819, ISBN 978-0-471-76865-4 [dostęp 2024-10-27] (ang.).
- ↑ ICSC 1407 - Phosphorus pentasulfide [online], chemicalsafety.ilo.org [dostęp 2024-10-27].
- ↑ Turan Ozturk, Erdal Ertas, Olcay Mert, A Berzelius Reagent, Phosphorus Decasulfide (P4S10), in Organic Syntheses, „Chemical Reviews”, 110 (6), 2010, s. 3419–3478, DOI: 10.1021/cr900243d, ISSN 0009-2665 [dostęp 2024-10-27] (ang.).
- ↑ I. Thomsen i inni, Thiation with 2,4-bis(4-methoxyphenyl)-1,3,2,4-dithiadiphosphetane 2,4-disulfide: N-methylthiopyrrolidone, „Organic Syntheses”, 62, 1984, s. 158, DOI: 10.15227/orgsyn.062.0158, ISSN 0078-6209 [dostęp 2024-10-27] (ang.).
- ↑ Jan Bergman i inni, Thionations Using a P4S10−Pyridine Complex in Solvents Such as Acetonitrile and Dimethyl Sulfone, „Journal of Organic Chemistry”, 76 (6), 2011, s. 1546–1553, DOI: 10.1021/jo101865y, ISSN 0022-3263 [dostęp 2024-10-27] (ang.).
- 1 2 3 Gerhard Bettermann i inni, Phosphorus Compounds, Inorganic, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2012, s. 10–11, DOI: 10.1002/14356007.a19_527 (ang.).
- ↑ Zinc dialkyl dithiophosphates [online], American Chemical Society [dostęp 2024-10-26] (ang.).
- ↑ Allyson M. Barnes, Keith D. Bartle, Vincent R.A. Thibon, A review of zinc dialkyldithiophosphates (ZDDPS): characterisation and role in the lubricating oil, „Tribology International”, 34 (6), 2001, s. 389–395, DOI: 10.1016/S0301-679X(01)00028-7, ISSN 0301-679X [dostęp 2024-10-26].
- ↑ Baki Yarar, Rüdiger B. Richter, Flotation, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2016, s. 9, DOI: 10.1002/14356007.b02_23.pub2 (ang.).
- ↑ John H. Fletcher i inni, The Synthesis of Parathion and Some Closely Related Compounds, „Journal of the American Chemical Society”, 72 (6), 1950, s. 2461–2464, DOI: 10.1021/ja01162a028, ISSN 0002-7863 [dostęp 2024-10-26] (ang.).
- ↑ Iwona Połeć i inni, Simple syntheses of malathion and malaoxon enantiomers, and isomalathion diastereoisomers: toxicity-configuration relationship, „Pesticide Science”, 53 (2), 1998, s. 165–171, DOI: 10.1002/(SICI)1096-9063(199806)53:2<165::AID-PS747>3.0.CO;2-0 [dostęp 2024-10-26] (ang.).
Bibliografia
- Derek Edgar Charles Corbridge, Phosphorus: an outline of its chemistry, biochemistry and uses, wyd. 5, Studies in inorganic chemistry, Amsterdam Lausanne New York [etc.]: Elsevier, 1995, ISBN 978-0-444-89307-9 [dostęp 2024-10-27].