Dichromian amonu
| ||||||||||||||||||||||||||||||||||||||
próbka związku | ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
(NH | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
(NH | |||||||||||||||||||||||||||||||||||||
| Masa molowa |
252,06 g/mol | |||||||||||||||||||||||||||||||||||||
| Wygląd |
pomarańczowoczerwone kryształy[1] | |||||||||||||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||||||||||||
| Numer CAS | ||||||||||||||||||||||||||||||||||||||
| PubChem | ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||||||||
| Inne aniony | ||||||||||||||||||||||||||||||||||||||
| Inne kationy |
chromian amonu, siarczan amonu, azotan amonu | |||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||||||||||||
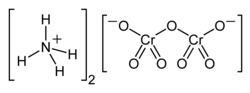
Dichromian amonu (nazwa Stocka: dichromian(VI) amonu), (NH
4)
2Cr
2O
7 – nieorganiczny związek chemiczny z grupy dichromianów, sól kwasu dichromowego i amoniaku.
Otrzymywanie
Otrzymywany jest w reakcji kwasu chromowego i wody amoniakalnej.
Właściwości
4)
2Cr
2O
7 (widoczny zielony Cr
2O
3)
Dichromian amonu tworzy pomarańczowe kryształy, dobrze rozpuszczalne w wodzie. Jest silnym utleniaczem i reaguje, często dość gwałtownie, z wszystkimi reduktorami. Jego cząsteczka, oprócz jonu dichromianowego o właściwościach utleniających, zawiera jon amonowy o właściwościach redukujących, co czyni ją niestabilną. Pod wpływem ogrzania ulega gwałtownemu rozkładowi z wydzielaniem dużej ilości puszystego zielonego tlenku chromu(III) i produktów gazowych:
- (NH
4)
2Cr
2O
7 → Cr
2O
3 + N
2↑ + 4H
2O↑
Reakcja ta wykorzystywana jest w pokazie pirotechnicznym chemiczny wulkan[6]. Rozkład termiczny w szczelnych pojemnikach może prowadzić do eksplozji[7].
Zastosowanie
Stosuje się go w pirotechnice, fotografii, jak również w litografii, jako źródło czystego azotu w laboratorium oraz jako katalizator. Wykorzystuje się go też jako zaprawy pigmentowej, jak również w syntezie alizaryny, garbarstwie i oczyszczaniu olei.
Zagrożenia
Dichromian amonu jest rakotwórczy (grupa 1 według Międzynarodowej Agencji Badań nad Rakiem)[3].
Wypadki
W roku 1986 w firmie Diamond Shamrock Chemicals w Ashtabuli w wyniku wybuchu ok. tony dichromianu amonu, który był suszony w nagrzewnicy, śmierć poniosły dwie osoby, a kolejnych 14 zostało rannych[8].
Przypisy
- 1 2 3 4 CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-46, ISBN 978-1-4987-5429-3 (ang.).
- ↑ Dichromian amonu, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2018-08-12] (ang.).
- 1 2 3 Dichromian amonu (nr 450138) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2018-08-12]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Dichromian(VI) amonu, międzynarodowa karta bezpieczeństwa chemicznego, Międzynarodowa Organizacja Pracy [dostęp 2018-08-12] (pol. • ang.).
- ↑ Dichromian amonu, [w:] CAMEO Chemicals [online] [dostęp 2018-08-12] (ang.).
- ↑ Will S. Deloach, John W. McHugh, Jerry Black, An ammonium dichromate “volcano”, „Journal of Chemical Education”, 28 (12), 1951, s. 649, DOI: 10.1021/ed028p649 (ang.).
- ↑ Jay A. Young, Ammonium Dichromate, „Journal of Chemical Education”, 82 (11), 2005, s. 1617, DOI: 10.1021/ed082p1617 (ang.).
- ↑ Stewart Diamond, Chemical in blast was being heated, „The New York Times”, 19 stycznia 1986, s. 22 [dostęp 2012-02-12].