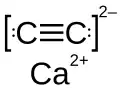Acetylenek wapnia
| ||||||||||||||||||||||||||||||||||
 karbid techniczny | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
CaC2 | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
64,10 g/mol | |||||||||||||||||||||||||||||||||
| Wygląd |
białe (czyste) lub szare (zanieczyszczone) ciało stałe | |||||||||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||||||||
| Numer CAS | ||||||||||||||||||||||||||||||||||
| PubChem | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||||
| Inne aniony | ||||||||||||||||||||||||||||||||||
| Inne kationy |
acetylenek magnezu, acetylenek miedzi(I), acetylenek miedzi(II) | |||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||||||||
Acetylenek wapnia, węglik wapnia, pot. karbid, CaC
2 – nieorganiczny związek chemiczny wapnia z grupy węglików jonowych o strukturze acetylenku[5].
Właściwości
- produkt techniczny jest czarny, szarawy lub brunatny ze słabym połyskiem
- na powietrzu pokrywa się wodorotlenkiem wapnia i węglanem wapnia, pod wpływem pary wodnej i dwutlenku węgla
- charakterystyczny zapach karbidu spowodowany jest zanieczyszczeniem fosforkiem wapnia, hydrolizującym do fosforiaku
Otrzymywanie
Karbid wytwarza się poprzez ogrzewanie mieszaniny koksu i wapna palonego do temperatury 2000–2100 °C w elektrycznym piecu łukowym. W tych temperaturach tlenek wapnia jest redukowany przez węgiel do węgliku wapnia i tlenku węgla, zgodnie z reakcją[6]:
- 3C + CaO → CaC
2 + CO↑
Produkt techniczny ma barwę szarą i jest zanieczyszczony węglem, tlenkiem wapnia oraz fosforkiem wapnia (Ca
3P
2, produkt redukcji fosforanu wapnia).
Reaktywność
- W warunkach normalnych reaguje egzotermicznie z wodą wydzielając acetylen:
- W temperaturze około 1100 °C reaguje z azotem cząsteczkowym dając cyjanamidek wapnia CaCN
2:
- CaC
2 + N
2 → CaCN
2 + C
Zastosowanie
- środek redukujący w hutnictwie[7] metali ciężkich
- produkcja azotniaku (nawozu sztucznego opartego na cyjanamidku wapnia)[7]
- produkcja acetylenu[7]
- dawniej jako źródło światła w przenośnych lampach karbidówkach[8] (karbidkach[9]) oraz w latarniach morskich (bezpośrednie spalanie acetylenu), dziś używany w niektórych latarkach czołowych, mających zastosowanie w speleologii
- petarda domowej roboty (puszka karbidowa)
- środek odstraszający przeciw kretom i nornicom w ogrodach[10]
Uwagi
- ↑ Oznakowanie zostało uzupełnione względem oznakowania zharmonizowanego na podstawie karty charakterystyki.
Przypisy
- 1 2 3 CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-53, ISBN 978-1-4987-5429-3 (ang.).
- ↑ calcium carbide, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2018-07-30] (ang.).
- ↑ Węglik wapnia (nr 270296) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2018-07-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Calcium carbide (nr 270296) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2018-07-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Adam Bielański, Podstawy chemii nieorganicznej, wyd. 5, Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 805, ISBN 83-01-13654-5.
- ↑ Calcium Carbide Manufacturing [online].
- 1 2 3 karbid, [w:] Encyklopedia Wiem [online], onet.pl [dostęp 2014-06-30] [zarchiwizowane z adresu 2014-06-29].[niewiarygodne źródło?]
- ↑ karbidówka, Witold Doroszewski (red.), [w:] Słownik języka polskiego PWN [dostęp 2014-06-30].
- ↑ karbidka, Witold Doroszewski (red.), [w:] Słownik języka polskiego PWN [dostęp 2014-06-30].
- ↑ Sposób użycia przeciwko kretom. karbid-sklep.pl. [zarchiwizowane z tego adresu (2012-03-31)]. karbid-sklep.pl.[niewiarygodne źródło?]