Reakcja Hecka
Reakcja Hecka – reakcja chemiczna substytucji polegająca na przyłączeniu nienasyconego związku organicznego (np. nienasyconego halogenku lub triflatu lub silanu) do alkenu z utworzeniem nowego wiązania węgiel-węgiel lub węgiel-azot. Reakcja ta zachodzi w silnie zasadowych warunkach i wymaga katalizy metaloorganicznej. Najczęściej katalizatorami są kompleksy palladu i rodu[1][2].
Nazwa pochodzi od nazwiska odkrywcy, amerykańskiego chemika Richarda Hecka, laureata Nagrody Nobla w dziedzinie chemii w 2010 r.
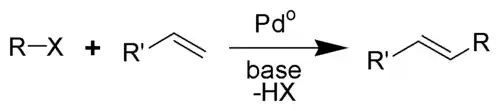
Reakcja ta zachodzi zwykle w sposób stereoselektywny – prowadząc do powstania większej ilości izomerów trans niż cis.
Mechanizm reakcji
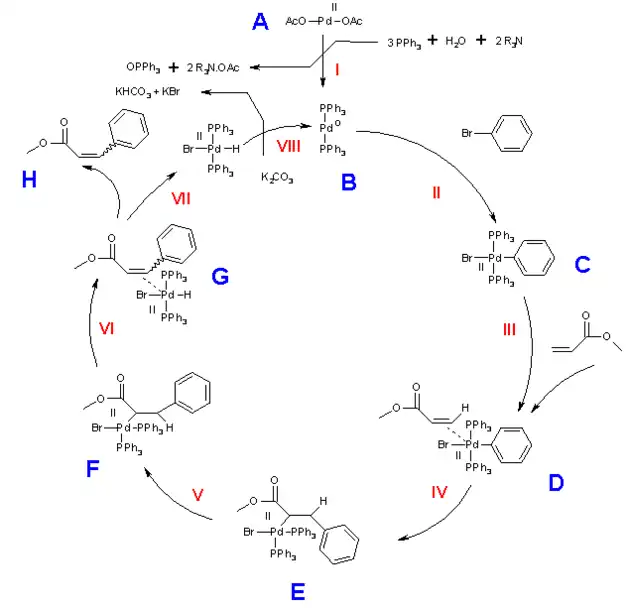
Mechanizm reakcji Hecka ma dość typowy przebieg dla reakcji chemicznych katalizowanych związkami metaloorganicznymi. Aktywnymi katalitycznie związkami są kompleksy palladu i rodu na zerowym stopniu utlenienia. Związki te jednak są wysoce niestabilne i dlatego zwykle otrzymuje się je in situ z prekursorów, w którym metal centralny występuje na II stopniu utlenienia[3].
Na poniższym przykładowym schemacie w pierwszym etapie reakcji octan palladu(II) jest redukowany przez trifenylofosfinę do palladu(0) (etap I). W II etapie następuje addycja oksydatywna, podczas której atom palladu wchodzi na miejsce dawnego wiązania węgiel-brom. W III etapie powstaje π-kompleks między atomem palladu a alkenem. W etapie IV następuje przekształcenie kompleksu π w σ-kompleks na skutek czego powstaje nowe wiązanie węgiel-węgiel. Czas życia związku przejściowego E jest zwykle na tyle długi, że możliwa jest rotacja wokół wiązania C–C do trwalszego konformeru anti (struktura F o naprężeniach sterycznych mniejszych niż w konformerze syn, tj. E). W etapie V W VI i VII etapie następuje eliminacja z utworzeniem podwójnego wiązania węgiel-węgiel i odtworzeniem wolnego kompleksu palladu(II), który w etapie VIII ulega reakcji z silną zasadą w wyniku czego odtwarza się aktywny katalitycznie kompleks palladu(0).
Zastosowania i odmiany
Klasyczna postać reakcji
Klasyczna postać reakcji Hecka jest stosowana do syntezy wielu związków chemicznych ze sprzężonymi wiązaniami podwójnymi węgiel-węgiel. Jest m.in. stosowana do produkcji naproksenu stosowanego jako lek przeciwzapalny i metoksycynamonianiu oktylu stosowanego w kremach do opalania jako filtr UV.
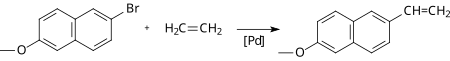
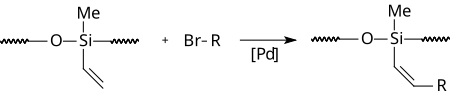
Reakcja ta jest też stosowana do syntezy modyfikacji polisiloksanów, np. w celu uzyskania materiału o wysokim współczynniku załamania światła[4].
Reakcja w cieczy jonowej
W środowisku cieczy jonowej reakcja Hecka zachodzi bez udziału ligandów fosforowych w strukturze katalizatora. Gdy katalizator jest osadzony na podłożu z porowatego silikażelu, reakcja może zachodzić w środowisku wodnym, a katalizator można wielokrotnie odzyskiwać[5].
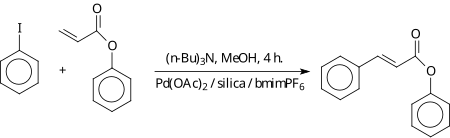
Utleniające arylowanie
Za pomocą reakcji Hecka można przeprowadzić utleniające arylowanie, w wyniku którego powstaje pierścień tetrahydrofuranowy (zaznaczony na czerwono) między dwoma pierścieniami arylowymi. Pierwszy etap procesu przebiega zgodnie z klasycznym cyklem katalitycznym reakcji Hecka, jednak na etapie produktu przejściowego addycji syn następuje substytucja ligandu palladowego przez grupę hydroksylową, co zamyka pierścień tetrahydrofuranowy[6].
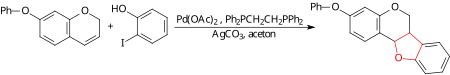
Reakcja z udziałem amin
W wersji z udziałem amin reakcja Hecka może doprowadzić od powstania wiązania azot-węgiel, zamiast węgiel-węgiel. W przykładowym procesie, oksym zawierający silnie elektronoakceptorową grupę pentafluorobenzoilową reaguje wewnątrzcząsteczkowo z dienem przyłączonym do drugiego końca cząsteczki. Rolę silnej zasady pełni w tej reakcji trietyloamina[7].
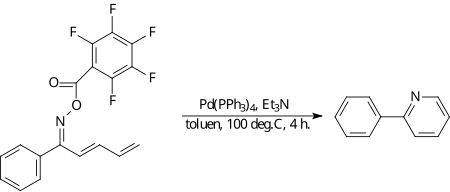
Przypisy
- ↑ R.F. Heck, J.P. Nolley, Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides, „Journal of Organic Chemistry”, 37 (14), 1972, s. 2320–2322, DOI: 10.1021/jo00979a024 [dostęp 2025-02-09] (ang.).
- ↑ Tsutomu Mizoroki, Kunio Mori, Atsumu Ozaki, Arylation of Olefin with Aryl Iodide Catalyzed by Palladium, „Bulletin of the Chemical Society of Japan”, 44 (2), 1971, s. 581–581, DOI: 10.1246/bcsj.44.581 [dostęp 2025-02-09] (ang.).
- ↑ Fumiyuki Ozawa, Akihiko Kubo, Tamio Hayashi, Generation of Tertiary Phosphine-Coordinated Pd(0) Species from Pd(OAc)2 in the Catalytic Heck Reaction, „Chemistry Letters”, 21 (11), 1992, s. 2177–2180, DOI: 10.1246/cl.1992.2177 [dostęp 2025-02-09] (ang.).
- ↑ Tomasz Ganicz i inni, A novel organometallic route to phenylethenyl-modified polysiloxanes, „J. Mater. Chem.”, 15 (5), 2005, s. 611–619, DOI: 10.1039/B413474E [dostęp 2025-02-09] (ang.).
- ↑ Hisahiro Hagiwara i inni, Sustainable Mizoroki–Heck reaction in water: remarkably high activity of Pd(OAc)2 immobilized on reversed phase silica gel with the aid of an ionic liquid, „Chemical Communications” (23), 2005, s. 2942, DOI: 10.1039/b502528a [dostęp 2025-02-09] (ang.).
- ↑ Loránd Kiss i inni, Further insight into the mechanism of Heck oxyarylation in the presence of chiral ligands, „Arkivoc”, 2003 (5), 2003, s. 69–76, DOI: 10.3998/ark.5550190.0004.507 [dostęp 2025-02-09] (ang.).
- ↑ Mitsuru Kitamura, Daisuke Kudo, Koichi Narasaka, Palladium(0)-catalyzed synthesis of pyridines from β-acetoxy-γ,δ-unsaturated ketone oximes, „Arkivoc”, 2006 (3), 2005, s. 148–162, DOI: 10.3998/ark.5550190.0007.312 [dostęp 2025-02-09] (ang.).