Tetrahydropiran
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C5H10O | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
86,13 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna ciecz o ostrym zapachu[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||
Tetrahydropiran, THP – heterocykliczny, organiczny związek chemiczny z grupy eterów, którego sześcioczłonowy pierścień zbudowany jest z pięciu atomów węgla i jednego atomu tlenu.
Pierścień tetrahydropiranu stanowi rdzeń piranoz – rodziny węglowodanów. Najbardziej powszechną piranozą jest glukoza.
Synteza
Klasyczną metodą syntezy organicznej tetrahydropiranu jest uwodornienie na niklu Raneya dihydropiranu[9].
Reakcje chemiczne
Tetrahydropiran jak większość eterów jest słabo reaktywny i dlatego może być stosowany jako rozpuszczalnik organiczny w reakcjach. W syntezie organicznej grupa 2-tetrahydropiranylowa jest stosowana jako grupa blokująca dla alkoholi[10][11].
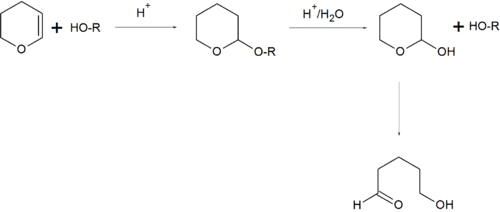
- Pierścień THP jako acetalowa grupa ochronna. Pierwszy etap – wprowadzenie THP do alkoholu ROH poprzez reakcję z dihydropiranem. Etap drugi: hydroliza kwasowa i uwolnienie alkoholu; powstały cykliczny hemiacetal jest nietrwały i hydrolizuje dalej do hydroksykwasu karboksylowego (5-hydroksywalerianowego)
Przypisy
- ↑ Tetrahydropyran, [w:] PubChem [online], United States National Library of Medicine, CID: 8894 (ang.).
- 1 2 3 4 5 Haynes 2014 ↓, s. 3-502.
- 1 2 Haynes 2014 ↓, s. 5-186.
- 1 2 3 Haynes 2014 ↓, s. 6-73.
- ↑ Haynes 2014 ↓, s. 5-197.
- 1 2 Haynes 2014 ↓, s. 15-21.
- ↑ Haynes 2014 ↓, s. 9-59.
- ↑ Tetrahydropiran (nr 293105) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2015-11-28]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ D.W. Andrus, John R. Johnson, Tetrahydropyran, „Organic Syntheses”, 23, 1943, s. 90, DOI: 10.15227/orgsyn.023.0090 (ang.).
- ↑ R.A. Earl, L.B. Townsend, Methyl 4-hydroxy-2-butynoate, „Organic Syntheses”, 60, 1981, s. 81, DOI: 10.15227/orgsyn.060.0081 (ang.).
- ↑ Arthur F. Kluge, Diethyl [(2-tetrahydropyranyloxy)methyl]phosphonate, „Organic Syntheses”, 64, 1986, s. 80, DOI: 10.15227/orgsyn.064.0080 (ang.).
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, ISBN 978-1-4822-0867-2 (ang.).