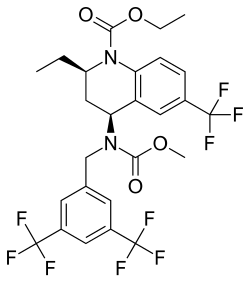
Torcetrapib
| ||||||||||||||||||||
| ||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||
| Wzór sumaryczny |
C26H25F9N2O4 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
600,47 g/mol | |||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||
| Numer CAS | ||||||||||||||||||||
| PubChem | ||||||||||||||||||||
| DrugBank | ||||||||||||||||||||
| ||||||||||||||||||||
| ||||||||||||||||||||
Torcetrapib – wielofunkcyjny organiczny związek chemiczny z grupy pochodnych tetrahydrochinoliny, inhibitor białka CETP (przenoszącego estry cholesterolu) pierwszej generacji. Został opracowany przez firmę Pfizer jako kandydat na lek w leczeniu miażdżycy.
III faza badań klinicznych, w których torcetrapib był podawany razem z atorwastatyną pacjentom z wysokim poziomem cholesterolu została przerwana 2 grudnia 2006 z powodu bezpieczeństwa[2][3]. Stwierdzono bowiem zwiększone o 58% ryzyko zgonu i większe o 25% ryzyko poważnych niepożądanych zdarzeń sercowo-naczyniowych wśród osób go zażywających[4]. Udowodniono również dysfunkcję śródbłonka u pacjentów z nadciśnieniem[5], podwyższenie poziomu aldosteronu przez większą aktywność syntazy aldosteronu[6] oraz niewielki wzrost ciśnienia tętniczego krwi[7].
Według zamysłu Pfizera lek miał być stosowany w preparacie złożonym, wspólnie z odkrytą i produkowaną również przez Pfizera atorwastatyną[8][9], która z kolei obniża poziom cholesterolu LDL. Stało się to przyczyną oskarżeń Pfizera, że uniemożliwia stosowanie przyszłego leku z preparatami obniżającymi stężenie LDL produkowanymi przez inne firmy[10].
Torcetrapib zwiększał poziom HDL co jak sądzono, wpłynie na cofanie się zmian miażdżycowych. W połączeniu z atorwastatyną dochodziło do obniżenia poziomu LDL (24,9% po 12 miesiącach[11] lub 18,9% po 8 tygodniach[7]) oraz podwyższenia poziomu HDL (72,1% po 12 miesiącach[11] lub 40,2% po 8 tygodniach[7]).
W momencie wycofania się z dalszych badań nad torcetrapibem akcje Pfizera spadły na giełdzie o ponad 10%[12].
Mechanizm
Estry cholesterolu są transportowane przez lipoproteiny o wysokiej gęstości (HDL) z komórek ciała do wątroby, gdzie zostają przetworzone. Lipoproteiny o niskiej gęstości (LDL) transportują zestryfikowany cholesterol do komórek, odkładając nadmiar w naczyniach krwionośnych, co jest czynnikiem rozwoju miażdżycy[13]. Istotną rolę w obiegu cholesterolu w organizmie człowieka pełni CETP – glikoproteina osocza wydzielana przez wątrobę i odgrywająca kluczową rolę w przekazywaniu estrów cholesterolu z HDL na VLDL i LDL[14]. Większość lipoprotein, na które przeniesiono cholesterol, jest następnie internalizowana przez hepatocyty za pomocą receptora apo B/E (i apoliproteiny E).
W przypadku inhibicji CETP przez torcetrapib, zahamowaniu ulega główna droga degradacji HDL (co powoduje wzrost jego stężenia), ale również główna droga odkładania cholesterolu z HDL do wątroby, w związku z czym, pomimo wzrostu stężenia HDL w organizmie, traci on swoje właściwości wymiatające cholesterol, przeciwmiażdżycowe i antyoksydacyjne, a stężenie cholesterolu wzrasta (również na skutek braku mechanizmu down regulation HMG-CoA). Jest to efekt niepożądany, ponieważ ma działanie aterogenne (sprzyjające rozwojowi miażdżycy).
Wzrost stężenia CETP skutkuje również zwiększeniem wydzielania X czynnika krzepnięcia, w wyniku czego dochodzi do aktywacji protrombiny, nadkrzepliwości i zakrzepicy naczyń żylnych[15].
Inne inhibitory CETP
W badaniach klinicznych również znalazły się inne substancje działające w takim mechanizmie:
- dalcetrapib
- evacetrapib
- anacetrapib
- obicetrapib
Przypisy
- ↑ Torcetrapib [online], karta charakterystyki produktu Sigma-Aldrich, 27 kwietnia 2023, numer katalogowy: PZ0170 [dostęp 2023-09-08]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Pfizer, A Phase 3, Double Blind, Placebo-Controlled, Randomized, Parallel Group, Multicenter Study of the Efficacy, Safety and Tolerability of Fixed Combination Torcetrapib/Atorvastatin Administered Orally Once Daily for 6 Months, Compared to Atorvastatin Alone or Placebo in Subjects With Mixed Dyslipidemia (Fredrickson Types IIa and IIb) [online], 15 lutego 2012 [dostęp 2025-03-12] (ang.).
- ↑ Phase 3, Multi-Center, Double-Blind, Randomized, Crossover Study Of The Efficacy, Safety, And Tolerability Of Fixed Combination Torcetrapib (Cp-529,414)/Atorvastatin, Compared With Atorvastatin Therapy Alone, And Fenofibrate Alone, In Subjects With Fredrickson Type III Hyperlipoproteinemia (Familial Dysbetalipoproteinemia). [online], 15 lutego 2012 [dostęp 2025-03-12] (ang.).
- ↑ Akihiro Inazu, Cholesteryl Ester Transfer Protein Inhibitors: A Hope Remains, [w:] Tsugikazu Komoda (red.), The HDL handbook. Biological Functions and Clinical Implications, wyd. 2, Amsterdam • Boston: Elsevier/Academic Press, 2014, s. 195–220, DOI: 10.1016/B978-0-12-407867-3.00008-1, ISBN 978-0-12-407867-3, OCLC 861317544 [dostęp 2025-05-19] (ang.).
- ↑ Margery A Connelly i inni, Torcetrapib Produces Endothelial Dysfunction Independent of Cholesteryl Ester Transfer Protein Inhibition, „Journal of Cardiovascular Pharmacology”, 55 (5), 2010, s. 459–468, DOI: 10.1097/FJC.0b013e3181cf03cb [dostęp 2025-05-19] (ang.).
- ↑ Roger G Clerc i inni, Mechanisms underlying off-target effects of the cholesteryl ester transfer protein inhibitor torcetrapib involve L-type calcium channels, „Journal of Hypertension”, 28 (8), 2010, s. 1676–1686, DOI: 10.1097/HJH.0b013e32833b1f8e [dostęp 2025-05-19] (ang.).
- 1 2 3 James M. i inni, Efficacy and Safety of Torcetrapib, a Novel Cholesteryl Ester Transfer Protein Inhibitor, in Individuals With Below-Average High-Density LipoproteinCholesterolLevelsonaBackgroundofAtorvastatin, „Journal of the American College of Cardiology”, 48 (9), 2006, s. 1782–1790, DOI: 10.1016/j.jacc.2006.06.066 [dostęp 2025-05-19] (ang.).
- ↑ Bruce D. Roth, The Discovery and Development of Atorvastatin, A Potent Novel Hypolipidemic Agent, [w:] F.D. King i inni red., Progress in Medicinal Chemistry, t. 40, Elsevier, 2002, s. 1–22, DOI: 10.1016/s0079-6468(08)70080-8, ISBN 978-0-444-51054-9 (ang.).
- ↑ Atorwastatyna [online], www.doz.pl [dostęp 2025-03-12].
- ↑ Wojciech Moskal, Podwójny lek Pfizera [online], Gazeta Wyborcza, 14 marca 2005.
- 1 2 John Bagdade i inni, Effects of Torcetrapib and Statin Treatment on ApoC-III and Apoprotein-Defined Lipoprotein Subclasses (from the ILLUMINATE Trial), „The American Journal of Cardiology”, 119 (11), 2017, s. 1753–1756, DOI: 10.1016/j.amjcard.2017.02.049 [dostęp 2025-05-19] (ang.).
- ↑ Śmiertelny lek na cholesterol, Pfizer zawiesza badania, [w:] Bankier.pl [online], 4 grudnia 2006.
- ↑ Lipidy i lipoproteiny [online], www.mp.pl [dostęp 2025-03-12].
- ↑ Philip J. Barter, John J.P. Kastelein, Targeting Cholesteryl Ester Transfer Protein for the Prevention and Management of Cardiovascular Disease, „Journal of the American College of Cardiology”, 47 (3), 2006, s. 492–499, DOI: 10.1016/j.jacc.2005.09.042 [dostęp 2025-05-19] (ang.).
- ↑ Kinta Hatakeyama, CETP Activity: A Link between Lipid Metabolism and Coagulation System, „Journal of Atherosclerosis and Thrombosis”, 23 (10), 2016, s. 1144–1146, DOI: 10.5551/jat.ED053, PMID: 27476666, PMCID: PMC5098913 [dostęp 2025-05-19] (ang.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.