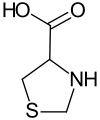
Tymonacyk
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny |
C4H7NO2S | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
133,17 g/mol | ||||||||||||||||||
| Wygląd |
bezbarwne ciało stałe[2] | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | |||||||||||||||||||
| PubChem | |||||||||||||||||||
| DrugBank | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||
| ATC | |||||||||||||||||||
| |||||||||||||||||||
Tymonacyk, tioprolina (łac. timonacicum) – organiczny związek chemiczny z grupy aminokwasów niebiałowych, karboksylowa pochodna tiazolidyny. Stosowany jako lek o działaniu hepatoprotekcyjnym i detoksykacyjnym w ostrych i przewlekłych schorzeniach wątroby o różnej etiologii oraz w toksycznym uszkodzeniu wątroby. Składnik kosmetyków do pielęgnacji i ochrony skóry[1].
Synteza
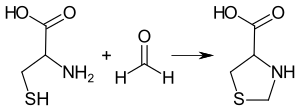
Synteza kwasu 4-tiazolidynokarboksylowego została po raz pierwszy opisana przez Maxwella Schuberta w 1936 r.[4] i niezależnie przez Hansa Thachera Clarke'a w 1937 r[2].
Związek powstaje w reakcji kondensacji formaldehydu z równomolową ilością cysteiny[2].
Stereochemia
Kwas tiazolidynokarboksylowy jest związkiem chiralnym z dwoma enancjomerami.
| Izomery tymonacyku | ||
| Nazwa | D-tymonacyk | L-tymonacyk |
| Inna nazwa | kwas (S)-4-tiazolidynokarboksylowy | kwas (R)-4-tiazolidynokarboksylowy |
| Wzór strukturalny | -1%252C3-Thiazolidine-4-carboxylic_acid.svg.png) | -1%252C3-Thiazolidine-4-carboxylic_acid.svg.png) |
| Numer CAS | 45521-09-3 | 34592-47-7 |
| 444-27-9 (DL) | ||
| Numer WE | 256-240-3 | 252-106-3 |
| 207-146-6 (DL) | ||
| ECHA | 100.051.111 | 100.047.355 |
| 100.006.498 (DL) | ||
| PubChem | 198253 | 93176 |
| 9934 (DL) | ||
| DrugBank | – | DB02846 |
| DB12856 (DL) | ||
| Wikidata | Q27133347 | Q27093808 |
| Q23637400 (DL) | ||
Występowanie
Obecność stwierdzono w twardniku japońskim[5] oraz rzodkiewniku pospolitym[6].
Preparaty handlowe
Preparaty tymonacyku dopuszczone do obrotu w Polsce: Heparegen, Timohep.
Przypisy
- 1 2 Ingredient: TIMONACIC [online], ec.europa.eu [dostęp 2025-08-17] (ang.).
- 1 2 3 4 5 6 7 8 9 S. Ratner, H.T. Clarke, The Action of Formaldehyde upon Cysteine, „Journal of the American Chemical Society”, 59 (1), 1937, s. 200, DOI: 10.1021/ja01280a050 (ang.).
- ↑ Tymonacyk, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2025-03-15] (ang.).
- ↑ Maxwell P. Schubert, Compounds of Thiol Acids with Aldehydes, „Journal of Biological Chemistry”, 1, 114, 1936, s. 341, DOI: 10.1016/S0021-9258(20)65226-7 (ang.).
- ↑ Y. Kurashima, M. Tsuda, T. Sugimura, Marked formation of thiazolidine-4-carboxylic acid, an effective nitrite trapping agent in vivo, on boiling of dried shiitake mushroom (Lentinus edodes), „Journal of Agricultural and Food Chemistry”, 38 (10), 2005, s. 1945-1949, DOI: 10.1021/JF00100A015 (ang.).
- ↑ M. Zook, R. Hammerschmidt, Origin of the Thiazole Ring of Camalexin, a Phytoalexin from Arabidopsis thaliana, „Journal of Agricultural and Food Chemistry”, 113 (2), 1997, s. 463-468, DOI: 10.1104/PP.113.2.463, PMID: 9046593 (ang.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.