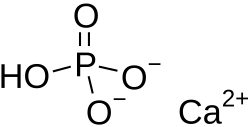
Wodorofosforan wapnia
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny |
CaHO4P | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
CaHPO4 | ||||||||||||||||||||||
| Masa molowa |
136,06 g/mol | ||||||||||||||||||||||
| Wygląd |
bezwonny biały proszek[2] | ||||||||||||||||||||||
| Minerały |
monetyt, bruszyt | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Inne aniony |
CaHAsO | ||||||||||||||||||||||
| Inne kationy |
BeHPO | ||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
Wodorofosforan wapnia (łac. calcii hydrogenophosphas) – nieorganiczny związek chemiczny, wodorosól wapniowa kwasu fosforowego. Ma postać białego bezwonnego proszku lub kryształków. Praktycznie nie rozpuszcza się w wodzie. Bezwodny wodorofosforan wapnia występuje w naturze jako minerał monetyt, a dihydrat jako bruszyt.
Otrzymywanie
Wodorofosforan wapnia może być otrzymywany przy użyciu roztworów chlorku wapnia i wodorofosforanu sodu[4][5]:
- CaCl
2 + Na
2HPO
4 → CaHPO
4 + 2NaCl
Innym sposobem jest reakcja kwasu fosforowego z wodą wapienną[4]:
- Ca(OH)
2 + H
3PO
4 → CaHPO
4 + 2H
2O
Wodorofosforan wapnia jest także produktem ubocznym otrzymywania hydroksyapatytu, podczas którego zachodzi reakcja kwasu fosforowego z fosforanem wapnia[4][5]:
- H
3PO
4 + Ca
3(PO
4)
2 → 3CaHPO
4
Zastosowanie
Stosowany jest jako suplement diety i źródło wapnia (zarówno w żywności, jak i w pożywieniu dla zwierząt) oraz zagęstnik i środek spulchniający do ciasta[4]. Używa się go również w wielu produktach stomatologicznych i medycznych, tworzywach sztucznych, nawozach oraz do produkcji szkła[4].
Przypisy
- 1 2 3 Farmakopea Polska VI, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2002, s. 1176, ISBN 83-88157-18-3.
- 1 2 3 4 5 Calcium hydrogen phosphate, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 3760 [dostęp 2010-10-08] (niem. • ang.).
- 1 2 3 4 David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, ISBN 978-1-4200-9084-0 (ang.).
- 1 2 3 4 5 6 7 8 9 Pradyot Patnaik, Handbook of Inorganic Chemicals, London: McGraw-Hill, 2003, s. 172–173, ISBN 0-07-049439-8 (ang.).
- 1 2 3 4 Merck Index. An Encyclopedia of Chemicals, Drugs, and Biologicals, wyd. 13, Whitehouse Station: Merck & Company, 2001, ISBN 0-911910-13-1, OCLC 224225657 (ang.).
- ↑ Calcium Phosphate, Dibasic, Dihydrate [online], karta charakterystyki produktu Sciencelab.com, 21 maja 2013 [zarchiwizowane z adresu 2016-03-04] (ang.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.