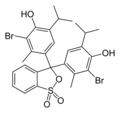
Błękit bromotymolowy
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny |
C27H28Br2O5S | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
624,38 g/mol | ||||||||||||||||||
| Wygląd |
czerwonaworóżowy lub brunatnawy proszek[1] | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | |||||||||||||||||||
| PubChem | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Podobne związki | |||||||||||||||||||
| Podobne związki | |||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||
Błękit bromotymolowy, 3′,3″-dibromotymolosulfonoftaleina – organiczny związek chemiczny, pochodna błękitu tymolowego, chemiczny wskaźnik pH. Czerwony proszek, praktycznie nierozpuszczalny w wodzie, rozpuszczalny w alkoholu etylowym, który przybiera w środowisku kwaśnym barwę żółtą, w zasadowym błękitną, a w środowisku obojętnym zieloną. Zakres zmiany barwy pH 6,0–7,6[5].
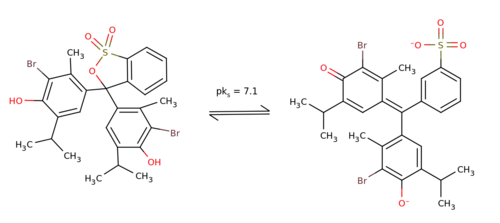
- Forma obojętna (po lewej) w środowisku kwaśnym i dianion (po prawej) w środowisku zasadowym
Powstaje w wyniku bromowania błękitu tymolowego w środowisku kwasu octowego.
| Błękit bromotymolowy | ||||
| poniżej pH 6,2 |
⇄ | pH 6,0–7,6 |
⇄ | powyżej pH 7,6 |

Przypisy
- 1 2 3 Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ Bromothymol blue, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2012-06-16] (ang.).
- ↑ Bromothymol Blue (nr 114413) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2018-07-11]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 8-51, ISBN 978-0-8493-0488-0 (ang.).
- 1 2 CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 8-16, ISBN 978-0-8493-0488-0 (ang.).