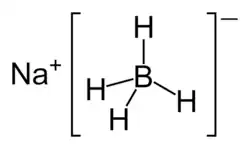
Borowodorek sodu
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Próbka związku | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
NaBH4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
37,83 g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwne, higroskopijne kryształy[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inne aniony | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inne kationy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Borowodorek sodu, NaBH4 – nieorganiczny związek chemiczny z grupy wodorków.
Jest to często używany reduktor. W alkoholach i wodzie rozpuszcza się, ulegając jednak rozkładowi – szybkiemu w wodzie, środowisku obojętnym i kwasowym (natomiast w pH 14 jest trwały), powolnemu w metanolu i etanolu (natomiast w izopropanolu jest trwały)[3].
Reakcja hydrolizy:
- NaBH
4 + 2H
2O → NaBO
2 + 4H
2↑
Otrzymywanie
Borowodorek sodu został otrzymany po raz pierwszy w latach 40. XX w. przez H. I. Schlessingera w celach wojskowych[4].
Można go uzyskać w reakcji wodorku sodu z boranem trimetylu w 250–270 °C:
- B(OCH3)3 + 4 NaH → NaBH4 + 3 NaOCH3
lub podczas działania wodorkiem sodu na sproszkowane szkło borokrzemianowe[5].
Zastosowania
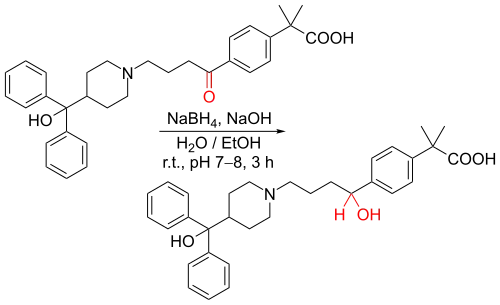
Borowodorek sodu redukuje aldehydy i ketony oraz niektóre reaktywne pochodne kwasów karboksylowych (np. chlorki kwasowe i estry tioli) do alkoholi. W przeciwieństwie do glinowodorku litu, niewspomagany borowodorek sodu nie redukuje zwykłych estrów, amidów ani kwasów karboksylowych[3]. Przykładem zastosowania borowodorku sodu jest etap redukcji podczas procesu produkcyjnego otrzymywania feksofenadyny (leku przeciwhistaminowego)[6]:
Przypisy
- ↑ Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- 1 2 3 4 Borowodorek sodu (nr 480886) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- 1 2 Luca Banfi i inni, Sodium Borohydride, [w:] L. Paquette (red.), Encyclopedia of Reagents for Organic Synthesis, Chichester, UK: John Wiley & Sons, Ltd, 2014, DOI: 10.1002/047084289x.rs052.pub3, ISBN 978-0-470-84289-8 (ang.).
- ↑ H.I. Schlesinger i inni, New Developments in the Chemistry of Diborane and the Borohydrides. I. General Summary 1, „Journal of the American Chemical Society”, 75 (1), 1953, s. 186–190, DOI: 10.1021/ja01097a049 [dostęp 2023-04-21] (ang.).
- ↑ Friedrich Schubert, Konrad Lang, Alex Buerger, Verfahren zur Herstellung von Alkaliboranaten, patent DE 1088930B, 15 września 1960 (niem.).
- ↑ Christian T. Goralski, Bakthan Singaram, Special Feature Section: Hydride Reductions. Editorial, „Organic Process Research & Development”, 10 (5), 2006, s. 947–948, DOI: 10.1021/op0601363 [dostęp 2023-04-21] (ang.).