Tetrahydroglinian litu
| |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
LiAlH4 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
37,95 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd |
Biały lub szary proszek | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
Tetrahydroglinian litu, glinowodorek litu, Li[AlH4] – nieorganiczny związek chemiczny, stosowany głównie jako silny środek redukujący i suszący.
W temperaturze pokojowej, czysty, rekrystalizowany tetrahydroglinian litu jest białym ciałem stałym o gęstości 0,917 g/cm³. Handlowo dostępny ma zwykle postać drobnoziarnistego pyłu lub tabletek o barwie ciemnoszarej, ze względu na zanieczyszczenie metalicznym glinem i jego tlenkami.
Związek ten energicznie reaguje z wodą według równania:
- Li[AlH4] + 4H2O → LiOH + Al(OH)3 + 4H2
Reakcja ta jest silnie egzotermiczna, co powoduje że pył tetrahydroglinianiu litu może się samorzutnie zapalić w kontakcie z wilgotnym powietrzem.
Otrzymuje się go, działając nadmiarem wodorku litu na eterowy roztwór chlorku glinu:
- 4LiH + AlCl3 → Li[AlH4] + 3LiCl
Budowa cząsteczki
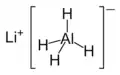
Centralnym atomem cząsteczki glinowodorku litu jest glin na III stopniu utlenienia, połączony kowalencyjnie z czterema atomami wodoru. Ujemny ładunek anionu kompleksowego [AlH4]− równoważony jest przez kation litu Li+.
Zastosowanie
Tetrahydroglinian litu jest często stosowany jako reduktor w chemii organicznej. Redukuje on na przykład kwasy karboksylowe do alkoholi, a azotyny do amin. W wyniku działania chlorkami na eterowy roztwór Li[AlH4] otrzymuje się odpowiednie wodorki, na przykład:
- SiCl4 + Li[AlH4] → SiH4 + LiCl + AlCl3
Przypisy
- ↑ Tetrahydroglinian litu, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2018-06-13] (ang.).
- ↑ Lithium Aluminum Hydride, [w:] CAMEO Chemicals [online], National Oceanic and Atmospheric Administration [dostęp 2018-06-13] (ang.).