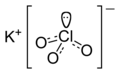
Chloran potasu
| |||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
KClO | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
122,55 g/mol | ||||||||||||||||||||||||||||||||||
| Wygląd |
biały lub prawie biały proszek, granulki lub kryształy[2] | ||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||
| Inne aniony |
KClO, KClO | ||||||||||||||||||||||||||||||||||
| Inne kationy | |||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||
Chloran potasu, nazwa Stocka: chloran(V) potasu, KClO
3 – nieorganiczny związek chemiczny, sól potasowa kwasu chlorowego. Stosowany do produkcji zapałek i materiałów wybuchowych[6].
Otrzymywanie
Na skalę przemysłową otrzymywany jest czasami w procesie elektrolizy roztworu chlorku potasu. W przestrzeni anodowej zachodzą następujące reakcje[7]:
- 2Cl−
→ Cl
2 + 2e− - Cl
2 + H
2O ⇄ HClO + H+
+ Cl− - HClO ⇄ H+
+ ClO− - 2HClO + ClO−
→ ClO−
3 + 2Cl−
+ 2H+
Anody do tego procesu pokrywane są powłokami z RuO
2 lub tytanu, aby zapewnić ich trwałość chemiczną.
W analogicznym procesie elektrochemicznym częściej otrzymuje się chloran sodu (jako roztwór wodny), z którego następnie wytrąca się chloran potasu po dodaniu stałego KCl[7]:
- KCl + NaClO
3 → NaCl + KClO
3↓
Jest to główna przemysłowa metoda produkcji tego związku. Pozostała solanka jest zawracana do elektrolizera i wykorzystywana ponownie[7].
Inną metodą otrzymywania KClO
3 jest przepuszczanie gazowego chloru przez gorący roztwór wodorotlenku potasu[8]:
- 3Cl
2 + 6KOH → KClO
3 + 5KCl + 3H
2O
Przypisy
- ↑
 kalichlorek [w:] Słownik języka polskiego [online], PWN [dostęp 2022-02-03].
kalichlorek [w:] Słownik języka polskiego [online], PWN [dostęp 2022-02-03]. - ↑ Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- 1 2 Chloran potasu [online], karta charakterystyki produktu Sigma-Aldrich, 20 listopada 2024, numer katalogowy: 255572 [dostęp 2025-01-01]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- 1 2 3 4 5 Potassium chlorate, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 2060 [dostęp 2025-01-01] (niem. • ang.).
- ↑ Potassium chlorate [online], karta charakterystyki produktu Sigma-Aldrich, numer katalogowy: 255572 [dostęp 2018-07-11] (ang.). (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 71, ISBN 83-7183-240-0.
- 1 2 3 Helmut Vogt i inni, Chlorine Oxides and Chlorine Oxygen Acids, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, s. 22–32, DOI: 10.1002/14356007.a06_483 (ang.).
- ↑ Pradyot Patnaik, Handbook of Inorganic Chemicals, London: McGraw-Hill, 2003, s. 745, ISBN 0-07-049439-8 (ang.).