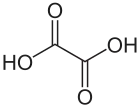
Kwas szczawiowy
| |||||||||||||||||||||||||||||||||
 kwas szczawiowy dihydrat | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
H | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
H | ||||||||||||||||||||||||||||||||
| Masa molowa |
90,03 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd |
białe kryształy | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
Kwas szczawiowy, kwas etanodiowy, HOOC−COOH – organiczny związek chemiczny, najprostszy kwas dikarboksylowy. Występuje w wielu roślinach (m.in. w szczawiu i rabarbarze)[6].
Otrzymywanie
Otrzymuje się go poprzez ogrzewanie mrówczanu sodu do temperatury ok. 400 °C[6], w wyniku czego powstaje szczawian sodu, który następnie przeprowadza się w kwas szczawiowy za pomocą rozcieńczonego kwasu siarkowego.
Inne metody to przepuszczenie dwutlenku węgla nad metalicznym sodem lub potasem w temperaturze 360 °C, a także utlenienie glikolu etylowego lub utlenianie wielu innych związków organicznych (np. cukrów) kwasem azotowym. Kwas szczawiowy można także otrzymać w reakcji acetylenu z nadmanganianem potasu.
Światowa produkcja kwasu szczawiowego i jego estrów wynosi ok. 140 tys. ton rocznie.
Właściwości
Rozpuszcza się zarówno w wodzie, jak i w rozpuszczalnikach organicznych (etanol, eter dietylowy). Z roztworu wodnego krystalizuje w postaci dihydratu (COOH)
2·2H
2O. Tworzy sole i wodorosole – szczawiany.
Kwas szczawiowy jest jednym z najmocniejszych kwasów karboksylowych – jego stała dysocjacji Ka1 wynosi 5,4×10−2, a Ka2 5,2×10−5[7]. Jest to spowodowane wzajemnym efektem indukcyjnym dwóch grup karboksylowych.
Podczas ogrzewania ulega dekarboksylacji do kwasu mrówkowego i dwutlenku węgla[6]:
- HOOC−COOH → H−COOH + CO
2
Wobec utleniaczy (np. nadmanganianu potasu) ma właściwości redukujące.
Zastosowanie
- Do usuwania rdzy.
- W elektrotechnice jest środkiem pomocniczym przy elektrolitycznym oksydowaniu glinu (Eloxal).
- W analizie miareczkowej jest substancją wzorcową do nastawiania miana roztworów utleniających.
- W pszczelarstwie jest stosowany do zwalczania roztocza Varroa destructor.
- Wywabianie plam atramentu.
- W farbiarstwie i proszkach do czyszczenia urządzeń sanitarnych.
Zagrożenia
W dużych stężeniach kwas szczawiowy działa drażniąco na skórę i błony śluzowe, ale nawet w ilościach spotykanych w żywności może być szkodliwy – z jonami wapnia tworzy trudno rozpuszczalny szczawian wapnia, który osadza się w postaci kamieni w nerkach. Dlatego częste spożywanie dużych ilości warzyw zawierających ten kwas może być przyczyną kamicy nerkowej, a także niedoboru wapnia w organizmie.
Przypisy
- 1 2 Henri A. Favre, Warren H. Powell, Nomenklatura związków organicznych. Rekomendacje IUPAC i nazwy preferowane 2013, Komisja Terminologii Chemicznej Polskiego Towarzystwa Chemicznego (tłum.), wyd. 1, Narodowy Komitet Międzynarodowej Unii Chemii Czystej i Stosowanej, [2016], s. 387.
- 1 2 3 4 5 6 7 8 Haynes 2016 ↓, s. 3-430.
- 1 2 Haynes 2016 ↓, s. 5-160.
- ↑ Haynes 2016 ↓, s. 5-95.
- ↑ Kwas szczawiowy (nr 75688) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2017-12-14]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- 1 2 3 Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 216, ISBN 83-7183-240-0.
- ↑ Robert T. Morrison, Robert N. Boyd, Chemia organiczna, Warszawa: Państwowe Wydawnictwo Naukowe, 1985, s. 697, ISBN 83-01-04166-8.
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).