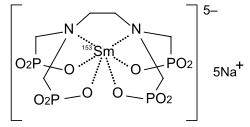
Leksydronam samaru-153
| |||||||||||||
| |||||||||||||
| Ogólne informacje | |||||||||||||
| Wzór sumaryczny |
C | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
589,05 g/mol | ||||||||||||
| Identyfikacja | |||||||||||||
| PubChem | |||||||||||||
| |||||||||||||
| |||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||
| Klasyfikacja medyczna | |||||||||||||
| ATC | |||||||||||||
| |||||||||||||
| |||||||||||||
Leksydronam samaru-153 (łac. samarium lexidronami) – związek promieniotwórczego izotopu samaru-153, stosowany w ogólnoustrojowym leczeniu bólu nowotworowego.
Mechanizm działania
Leksydronam samaru-153 wykazuje bardzo wysokie powinowactwo do tkanki kostnej, gromadząc się w miejscach nasilonego metabolizmu związanego z hydroksyapatytem. Badania na zwierzętach wskazują, że lek odkłada się w osteoidach, w których zachodzi mineralizacja. Wykazano, że leksydronam samaru-153 wykazuje znacznie większe powinowactwo do tkanki kostnej objętej nowotworem. Dlatego też jego stężenie jest tam znacznie większe niż w otaczającej nowotwór zdrowej kości.
1 ml roztworu leksydronamu samaru-153 wykazuje radioaktywność rzędu 1,3 GBq, co odpowiada 20–46 μg/ml samaru-153. Właściwa aktywność promieniotwórcza samaru-153 wynosi 28–65 mBq/μg. Okres półtrwania tego izotopu wynosi 1,93 dnia[1].
Nie wiadomo, jaki mechanizm preparatu wpływa na jego działanie przeciwbólowe. Złagodzenie bólów następuje po około 1 tygodniu od momentu podania i utrzymuje się nawet do 4 miesięcy[2].
Farmakokinetyka
Preparat jest bardzo szybko usuwany z krążenia ogólnego. Po około 30 minutach od momentu podania we krwi pozostawało tylko około 10% podanej dawki. Lek w ciągu 24 godzin znika z krążenia. Największe wydalanie leksydronamu samaru-153 ma miejsce 4 godziny po podaniu. Lek wydalany jest z moczem w postaci niezmienionej. Znacznie mniejsze wydalanie obserwuje się u pacjentów z rozległymi nowotworami kości. Całkowity wychwyt preparatu przez kościec stanowi około 75% podanej dawki[3].
Wskazania
Leksydronam samaru-153 stosuje się do zwalczania nowotworowych bólów kości u pacjentów z mnogimi osteoblastycznymi ogniskami nowotworowymi[4]. Preparat powinien być podawany wyłącznie w sytuacji, gdy scyntygrafia kości wykazała, że gromadzą się w nich bifosfoniany znakowane technetem (99mTc)[5].
Przeciwwskazania
- nadwrażliwość na substancję czynną, bifosfoniany lub jakikolwiek inny składnik preparatu
- ciąża i karmienie piersią
- pacjenci leczeni chemioterapią lub radioterapią zewnętrzną obejmującą ponad połowę powierzchni ciała na 6 tygodni przed rozpoczęciem leczenia leksydronamem samaru-153
- chorzy z potwierdzonym zmniejszeniem rezerwy szpikowej
- dzieci i młodzież do 18 roku życia
Ostrzeżenia specjalne
- Leksydronam samaru-153 może być podawany wyłącznie przez wykwalifikowany personel, doświadczony w podawaniu radiofarmaceutyków. Należy więc przedsięwziąć szczególne środki ostrożności.
- Preparat jest lekiem ostatniej szansy, stosowanym w leczeniu paliatywnym[6].
- Lek może powodować supresję szpiku. Należy kontrolować morfologię krwi przez co najmniej 8 tygodni, począwszy od 2. tygodnia po podaniu ostatniej dawki.
- Przed podaniem, pacjenta należy nawodnić. Należy również zadbać o to, by chory opróżniał pęcherz tak często, jak to tylko możliwe. W przypadku nietrzymania moczu lub niedrożności moczowodów należy zastosować cewnik.
- Przed wdrożeniem leczenia preparatem należy ocenić, czy ryzyko związane z napromieniowaniem jest mniejsze niż to wynikające z choroby.
- Po rozmrożeniu roztwór zużyć w ciągu 6 godzin.
Leksydronamu samaru-153 nie należy stosować łącznie z chemio- lub radioterapią[7]. Nie należy mieszać preparatu z innymi lekami podawanymi dożylnie ze względu na możliwość wystąpienia niezgodności.
Działania niepożądane
Najczęściej występujące objawy uboczne to spadek liczby krwinek białych, płytek krwi[8] oraz niedokrwistość. Znacznie rzadziej występują:
- toksyczność hemopoetyczna
- pozorne nasilenie bólów kostnych
- reakcje alergiczne, w tym anafilaktyczne
- zaburzenia przewodu pokarmowego
- nadmierna potliwość
- ucisk rdzenia kręgowego lub korzeni rdzeniowych
- zespół rozsianego wykrzepiania wewnątrznaczyniowego.
Dawkowanie
Dawka zalecana to 37 MBq/kg mc[9]. Preparat należy podawać powoli w ciągu jednej minuty.
Preparaty
- Quadramet – CIS bio international – fiolka o pojemności 15 ml, zawierająca od 1,5 do 3,1 ml roztworu. Preparat dostarczany jest w postaci zamrożonej w suchym lodzie.
Przypisy
- ↑ J.C. Heggie, Samarium-153-EDTMP dosimetry, „Journal of Nuclear Medicine”, 35 (1), 1994, s. 191–192, PMID: 8271053.
- ↑ M. Farhanghi i inni, Samarium-153-EDTMP: pharmacokinetic, toxicity and pain response using an escalating dose schedule in treatment of metastatic bone cancer, „Journal of Nuclear Medicine”, 33 (8), 1992, s. 1451–1458, PMID: 1378887.
- ↑ P. Pusuwan i inni, Pharmacokinetics of samarium-153-EDTMP in disseminated skeletal metastases, „Journal of the Medical Association of Thailand”, 79 (9), 1996, s. 579–584, PMID: 8996987.
- ↑ A.N. Serafini, Therapy of metastatic bone pain, „Journal of Nuclear Medicine”, 42 (6), 2001, s. 895–906, PMID: 11390554.
- ↑ L. Bianchi i inni, Prospective dosimetry with 99mTc-MDP in metabolic radiotherapy of bone metastases with 153Sm-EDTMP, „European Journal of Nuclear Medicine and Molecular Imaging”, 36 (1), 2009, s. 122–129, DOI: 10.1007/s00259-008-0926-7, PMID: 18751975.
- ↑ M.G.E.H. Lam i inni, Bone seeking radiopharmaceuticals for palliation of pain in cancer patients with osseous metastases, „Anti-Cancer Agents in Medicinal Chemistry”, 7 (4), 2007, s. 381–397, PMID: 17630915.
- ↑ D.E. Heron i inni, Myelotoxicity of samarium Sm 153 lexidronam in patients receiving prior treatment with chemotherapy or radiotherapy, „Annals of Oncology”, 19 (9), 2008, s. 1639–1643, DOI: 10.1093/annonc/mdn178, PMID: 18467311.
- ↑ K. Weiss i inni, Platelet function after single [153Sm]EDTMP therapy in prostate cancer, „The Quarterly Journal of Nuclear Medicine and Molecular Imaging”, 50 (4), 2006, s. 330–333, PMID: 17043630.
- ↑ J.F. Eary i inni, Samarium-153-EDTMP biodistribution and dosimetry estimation, „Journal of Nuclear Medicine”, 34 (7), 1993, s. 1031–1036, PMID: 7686217.
Bibliografia
- Sprawozdanie producenta preparatu (EPAR) – plik pdf. [dostęp 2009-04-20]. [zarchiwizowane z tego adresu (30 lipca 2007)]. (pol.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.