Penicillium decumbens
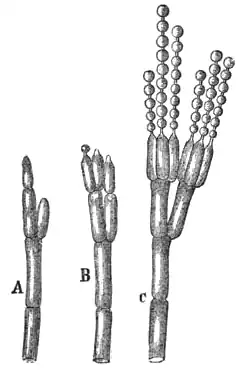 Typy penicillusa u Penicillium; A - monowertycjoidalny, B - diwertycjoidalny, C - triwertycjoidalny | |
| Systematyka | |
| Domena | |
|---|---|
| Królestwo | |
| Typ | |
| Klasa | |
| Rząd | |
| Rodzina | |
| Rodzaj | |
| Gatunek |
Penicillium decumbens |
| Nazwa systematyczna | |
| Penicillium decumbens Thom Bull. U.S. Department of Agriculture, Bureau Animal Industry 181: 71 (1910) | |
Penicillium decumbens Thom – gatunek grzybów z klasy Eurotiomycetes[1]. Mikroskopijne grzyby strzępkowe.
Systematyka
Pozycja w klasyfikacji według Index Fungorum: Penicillium, Aspergillaceae, Eurotiales, Eurotiomycetidae, Eurotiomycetes, Pezizomycotina, Ascomycota, Fungi[1].
Po raz pierwszy opisał go w 1910 roku Charles Thom[1]. Synonimy[2]:
- Eupenicillium meridianum D.B. Scott 1968
- Penicillium arabicum Baghd. 1968
- Penicillium decumbens var. atrovirens S. Abe 1956
- Penicillium glaucolanosum Chalab. 1950
- Penicillium meridianum D.B. Scott 1968
Morfologia i fizjologia
Kolonie na agarze z roztworem Czapeka rozrastają się powoli, osiągając średnicę 2–3 cm w ciągu 12–14 dni w temperaturze pokojowej, u niektórych szczepów są prawie aksamitne, u innych wykazują tendencję do tworzenia białych przerostów grzybni w centralnych obszarach, u jeszcze innych są prawie kłaczkowate i osiągają grubość do 1–2 mm. Wszystkie jednak charakteryzują się luźno splecionymi i zwisającymi strzępkami, zawierającymi krótkie konidiofory, zarodnikujące na całej powierzchni kolonii, marginalny wzrost u niektórych szczepów jest bardzo cienki, w dużej mierze zanurzony w strefach o szerokości 1–3 mm, zabarwiony na odcienie od szarożółtozielonych do herbacianozielonych, w starszych koloniach rozwijają się na powierzchni kępki sterylnej wtórnej grzybni. Wysięku brak, lub jest niepozorny, zapach charakterystyczny, aromatyczny, podobny do mydła. Rewers bezbarwny lub z lekkim zielonkawym odcieniem[3].
Kolonie na agarze z ekstraktem słodowym rosną szybciej, do 4–6 cm po 2 tygodniach, są płaskie, tej samej barwy co na Czapeku, ale blednące z wiekiem do odcieni szarobrązowych, bardzo silnie zarodnikujące. Penicyle wytwarzane obficiej i często nieco większe niż na Czapeku, ale wytwarzające luźne kolumny zarodników o długości do 250 µm[3].
Konidiofory 50–100 × 2–2,5 µm, z wierzchołkami lekko powiększonymi, gładkimi lub drobno chropowatymi, wyrastające w kolejnych węzłach na wystających strzępkach, które w obszarach brzeżnych wielu szczepów rosną jak stolony wzdłuż podłoża. Penicillusy prawie całkowicie monovertycjalne i tylko sporadycznie wykazujące rozgałęzienia. Tworzą luźne kolumny konidiów o długości do 100 µm. Ramiona penicillusów przeważnie w zwartych skupiskach do 12 lub 15, o wymiarach 7–9 × 2–2,5 µm, czasami wyrastające na dwóch bezpośrednio sąsiadujących poziomach. Konidia eliptyczne do prawie kulistych 2–2,5 µm w osi długiej, sporadycznie do 3 µm, gładkie, wydające się lekko zielone pod mikroskopem[3].
Występowanie i siedlisko
Podano występowanie Penicillium decumbens w Ameryce Północnej, Europie, Azji, Afryce, Australii i Antarktyce, najwięcej stanowisk w Australii[4]. Grzyb glebowy. W Polsce podano liczne notatki o wyizolowaniu go z gleby, ryzosfery, korzeni, siewek i nasion różnych roślin uprawnych[5].
Znaczenie
- P. decumbens wykazuje się dużą skutecznością w produkcji lipidów i może być wykorzystany w procesach biotechnologicznych do ich wytwarzania z substratu celulozowego. Najliczniej wytwarzanymi przez niego kwasami tłuszczowymi są: kwas palmitynowy, oleinowy, linolowy i stearynowy[6].
- Jest od 1996 r. w Chinach stosowany do przemysłowej produkcji celulazy[7].
- Był stosowany w laboratoryjnej lub pilotażowej produkcji etanolu i wodoru z materiałów lignocelulozowych[7].
- Prowadzi się badania nad zastosowaniem go do biorafinacji biomasy lignocelulozowej na paliwa płynne i chemikalia. Stosuje się do tego celu zwykle Trichoderma reesei, ale P. decumbens produkuje układy enzymatyczne o lepszej wydajności i po przeprowadzeniu prac badawczych może się okazać w tym zakresie lepszym rozwiązaniem[7].
- Jest stosowany do fermentacji melasy buraczanej[8].
Przypisy
- 1 2 3 Index Fungorum [online] [dostęp 2020-10-19] (ang.).
- ↑ Species Fungorum [online] [dostęp 2020-10-19] (ang.).
- 1 2 3 K.B. Raper, C. Thom, A manual of the Penicillia, Mycobank, 1949, s. 1–878 [dostęp 2024-12-20].
- ↑ Występowanie Penicillium decumbens na świecie (mapa) [online], gbif.org [dostęp 2020-10-19] (ang.).
- ↑ Wiesław Mułenko, Tomasz Majewski, Małgorzata Ruszkiewicz-Michalska, Wstępna lista grzybów mikroskopijnych Polski, Kraków: W. Szafer. Institute of Botany, PAN, 2008, s. 444, ISBN 978-83-89648-75-4.
- ↑ B. Avenda˜no-Morales, R. Hern´andez-Mart´ınez, I. Valdez-Vazquez, Lipid production by Penicillium decumbens from the direct conversion of seaweed bagasse, „Revista Mexicana de Ingeniería Química”, 6 (3), 2017, s. 691–702 [dostęp 2024-12-20].
- 1 2 3 Guodong Liu i inni, Genomic and Secretomic Analyses Reveal Unique Features of the Lignocellulolytic Enzyme System of Penicillium decumbens [online], PLOS ONE, 2013 [dostęp 2024-12-20].
- ↑ Antonia M. Jiménez i inni, Influence of Aerobic Pretreatment with Penicillium decumbens on the Anaerobic Digestion of Beet Molasses Alcoholic Fermentation Wastewater in Suspended and Immobilized Cell Bioreactors [online] [dostęp 2020-10-19] (ang.).