Pentatlenek diazotu
| |||||||||||||||||||||||
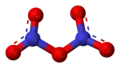
 struktura N 2O 5 w formie kowalencyjnej | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny |
N2O5 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
108,01 g/mol | ||||||||||||||||||||||
| Wygląd |
bezbarwne kryształy[2] | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
Pentatlenek diazotu (nazwa Stocka: tlenek azotu(V)), N
2O
5 – nieorganiczny związek chemiczny z grupy tlenków azotu, w którym każdy atom azotu występuje na formalnym stopniu utlenienia V.
Budowa
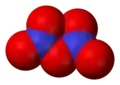
W zależności od warunków, pentatlenek diazotu może występować w dwóch formach, kowalencyjnej i jonowej:
- N
2O
5 ⇌ [NO
2]+
[NO
3]−
W stanie gazowym i w rozpuszczalnikach niepolarnych (np. w CCl
4) N
2O
5 ma prawdopodobnie budowę kowalencyjną z mostkiem tlenowym łączącym atomy azotu (N−O−N). Badania rentgenograficzne dowiodły, że w stanie stałym ma on strukturę jonową – [NO
2]+
[NO
3]−
– jest więc solą, azotanem nitroniowym. Szybkie schłodzenie gazowego N
2O
5 pozwala na uzyskanie metastabilnej kowalencyjnej formy związku w stanie stałym, która w temperaturze powyżej −70 °C przechodzi egzotermicznie w formę jonową[5].
Otrzymywanie
W warunkach laboratoryjnych otrzymuje się go przez ostrożne odwodnienie kwasu azotowego pentatlenkiem difosforu[3]:
- 2HNO
3 + P
2O
5 → 2HPO
3 + N
2O
5
Inne metody syntezy to utlenianie dwutlenku azotu lub innych niższych tlenków azotu ozonem oraz reakcje azotanu srebra z chlorem lub trichlorkiem fosforylu (POCl) na gorąco, np.
- 2AgNO
3 + Cl
2 → AgCl + 2NO
2Cl + O
2 - AgNO
3 + NO
2Cl → AgCl + N
2O
5
Właściwości
Pentatlenek diazotu w temperaturze pokojowej występuje w formie białych kryształków. Jest związkiem nietrwałym rozkładającym się spontanicznie w temperaturze pokojowej do dwutlenku azotu i tlenu. Z mocnymi kwasami daje sole nitroniowe i kwas azotowy, np.
- HClO
4 + N
2O
5 → NO
2ClO
4 + HNO
3
Związek ten reaguje gwałtownie z wodą, jest bezwodnikiem kwasu azotowego. Ze względu na jego nietrwałość nie znajduje on w formie czystej praktycznych zastosowań.
Przypisy
- 1 2 3 Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 318, ISBN 978-0-85404-438-2 (ang.).
- 1 2 3 4 5 CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-76, ISBN 978-1-4987-5429-3 (ang.).
- 1 2 Adam Bielański, Podstawy chemii nieorganicznej, t. 2, Warszawa: Państwowe Wydawnictwo Naukowe, 1994, s. 662, ISBN 83-01-06542-7.
- ↑ George L. Lewis, Charles P. Smyth, The Dipole Moments and Structures of Certain Nitro Compounds and Amines, „Journal of the American Chemical Society”, 61 (11), 1939, s. 3067–3070, DOI: 10.1021/ja01266a027 (ang.).
- ↑ A.F. Holleman, E. Wiberg, Inorganic Chemistry, San Diego: Academic Press, 2001, ISBN 0-12-352651-5.
Bibliografia
- Linus Pauling, Peter Pauling, Chemia, Warszawa: Wydawnictwo Naukowe PWN, 1998, s. 229, ISBN 83-01-12267-6.
- Philip John Durrant, Bryl Durrant, Zarys współczesnej chemii nieorganicznej, Warszawa: Państwowe Wydawnictwo Naukowe, 1965.