Modelowe błony bakteryjne
Modelowe błony bakteryjne – układy imitujące membrany komórek bakteryjnych, wykorzystywane w badaniach mających na celu określenie mechanizmów i interakcji zachodzących między składnikami budującymi błony bakteryjne, między białkami lub lekami i składnikami błony, lub między komórką bakteryjną a komórkami żywiciela[1][2]. Jednymi z najczęściej stosowanych modeli są liposomy[3][4], dwuwarstwy osadzone na ciele stałym[5][6] lub monowarstwy Langmuira[7][8][9]. Wszystkie wymienione podejścia wykorzystują fosfolipidy, będące głównym budulcem błon biologicznych. Są to m.in. fosfatydyloetanoloamina (PE), fosfatydyloglicerol (PG), fosfatydylocholina (PC), kardiolipina (CL) i fosfatydyloseryna (PS)[2][10][11]. Często stosuje się dodatek lipopolisacharydów (LPS)[12].
Monowarstwy Langmuira
Technika monowarstw Langmuira pozwala na utworzenie na granicy faz ciecz/powietrze warstewki imitującej błonę bakteryjną i jest jedną z najczęściej wykorzystywanych metod modelowania membran komórkowych. Naniesienie fosfolipidów rozpuszczonych w substancji niemieszalnej z wodą na powierzchnię polarnej subfazy prowadzi do powstania warstewki o grubości jednej cząsteczki[13]. Wynika to z amfifilowego charakteru cząsteczek fosfolipidów i ich specyficznej orientacji na powierzchni cieczy: fragmenty hydrofobowe ułożone są w sposób ograniczający dostęp do polarnej cieczy, podczas gdy części hydrofilowe silnie oddziałują z subfazą[14][11].
Głównymi danymi termodynamicznymi, które otrzymuje się podczas analiz przeprowadzanych przy pomocy techniki Langmuira są zależności ciśnienia powierzchniowego w funkcji powierzchni przypadającej na cząsteczkę, tzw. izotermy π-A[14][15]. Ponadto możliwy jest pomiar zmian potencjału powierzchniowego w funkcji powierzchni przypadającej na cząsteczkę (izotermy ΔV-A)[16], określenie stopnia upakowania cząsteczek[11], obserwacja morfologii powierzchni modelowej błony przy użyciu mikroskopu kąta Brewstera[14][17], analiza penetracji monowarstwy[15] przez peptydy lub przeniesienie warstewki na ciało stałe[10].
Badania penetracji monowarstw Langmuira
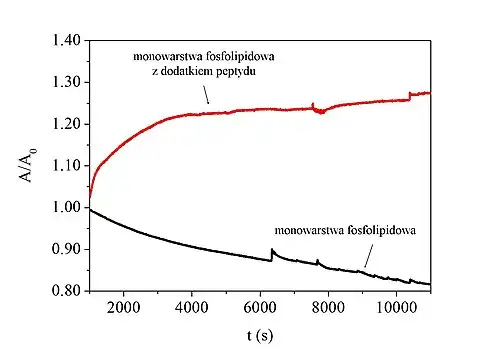
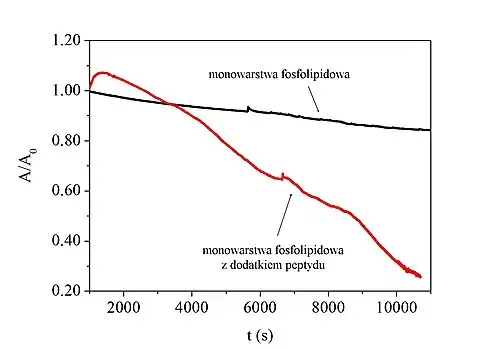
Analizy penetracji modelowych błon przez peptydy przeciwdrobnoustrojowe, antybiotyki lub inne substancje oddziałujące z membranami dostarczają informacji dotyczących mechanizmu ich działania[18].
Metodyka
Pomiary przeprowadzane są przy użyciu wanny Langmuira. Modelowe błony uzyskiwane są przez naniesienie fosfolipidów na powierzchnię cieczy i sprężenie ich za pomocą symetrycznych barierek. Podczas kompresji mierzone są zmiany ciśnienia powierzchniowego (π) w funkcji powierzchni przypadającej na cząsteczkę (A). Badania penetracji mogą być przeprowadzane na dwa sposoby – przy stałym ciśnieniu powierzchniowym lub stałej powierzchni przypadającej na cząsteczkę[19]. W pierwszym podejściu monowarstwa jest sprężana do określonej wartości ciśnienia powierzchniowego (np. 30 mN/m), po czym ciśnienie jest utrzymywane dzięki oscylacyjnym ruchom symetrycznych barierek. Po pewnym czasie peptyd (lub inna badana substancja) dozowany jest pod monowarstwę. Obserwowane są zmiany powierzchni przypadającej na cząsteczkę w czasie[20][9]. W drugim wspomnianym podejściu utrzymywana jest stałą wartość stosunku powierzchni na cząsteczkę i obserwowane są zmiany ciśnienia powierzchniowego w czasie.
Interpretacja wyników
Wynikiem analizy jest wykres zmian powierzchni przypadającej na cząsteczkę (przy stałym π) lub ciśnienia powierzchniowego (przy stałym A) w funkcji czasu (t). Wartości parametru ulegającego zmianie podczas analizy są normalizowane w celu porównania wpływu substancji na monowarstwy o różnym składzie, ze względu na zależność A od ilości cząsteczek substancji (masy molowej, stężenia i objętości roztworu), z której tworzone są modelowe błony na granicy faz ciecz–powietrze[21].
Wzrost powierzchni przypadającej na cząsteczkę przy utrzymywanym stałym ciśnieniu świadczy o wbudowaniu się substancji membranolitycznej w strukturę monowarstwy. Z kolei spadek tego parametru świadczy o desorpcji cząsteczek z monowarstwy do subfazy, co prowadzi do destabilizacji modelowej błony[19][13]. Analogicznie interpretowane są zmiany ciśnienia powierzchniowego przy stałej powierzchni na cząsteczkę – wzrost parametru świadczy o inkorporacji cząsteczek na granicy faz, zaś spadek sugeruje desorpcję[13].
Przykłady zastosowania
W literaturze opisanych jest wiele przykładów zastosowania badań penetracji do określenia mechanizmu działania środków membranolitycznych, takich jak np. peptydu LL-37 (ludzka katelicydyna)[20][9][13], pochodnych laktoferyny[22], melityny, lizyny oraz kardiotoksyny[19] względem modelowych błon bakteryjnych. W większości przypadków modelowe błony tworzone są z fosfolipidów wzorcowych, takich jak obojnaczy DPPC (1,2-dipalmitoilo-sn-glicero-3-fosfocholina) oraz anionowy DPPG (1,2-dipalmitoilo-sn-glicero-3-fosfo-rac-(1-glicerol))[19][13][23].
Przypisy
- ↑ Ashley B. Carey, Alex Ashenden, Ingo Köper, Model architectures for bacterial membranes, „Biophysical Reviews”, 14 (1), 2022, s. 111–143, DOI: 10.1007/s12551-021-00913-7, PMID: 35340604, PMCID: PMC8921416 [dostęp 2024-05-10] (ang.).
- 1 2 Shiqi Li i inni, Solid and Liquid Surface-Supported Bacterial Membrane Mimetics as a Platform for the Functional and Structural Studies of Antimicrobials, „Membranes”, 12 (10), 2022, s. 906, DOI: 10.3390/membranes12100906, PMID: 36295664, PMCID: PMC9609327 [dostęp 2024-05-10] (ang.).
- ↑ Yongchao Su i inni, Structures of β-Hairpin Antimicrobial Protegrin Peptides in Lipopolysaccharide Membranes: Mechanism of Gram Selectivity Obtained from Solid-State Nuclear Magnetic Resonance, „Biochemistry”, 50 (12), 2011, s. 2072–2083, DOI: 10.1021/bi101975v, PMID: 21302955, PMCID: PMC3062705 [dostęp 2024-05-10] (ang.).
- ↑ Antoine-Emmanuel Saliba i inni, A quantitative liposome microarray to systematically characterize protein-lipid interactions, „Nature Methods”, 11 (1), 2014, s. 47–50, DOI: 10.1038/nmeth.2734 [dostęp 2024-05-10] (ang.).
- ↑ E. Sackmann, Supported Membranes: Scientific and Practical Applications, „Science”, 271 (5245), 1996, s. 43–48, DOI: 10.1126/science.271.5245.43 [dostęp 2024-05-10] (ang.).
- ↑ Jakob Andersson i inni, Solid-supported lipid bilayers – A versatile tool for the structural and functional characterization of membrane proteins, „Methods”, 180, 2020, s. 56–68, DOI: 10.1016/j.ymeth.2020.09.005 [dostęp 2024-05-10] (ang.).
- ↑ Małgorzata Jurak, Robert Mroczka, Rafał Łopucki, Properties of Artificial Phospholipid Membranes Containing Lauryl Gallate or Cholesterol, „The Journal of Membrane Biology”, 251 (2), 2018, s. 277–294, DOI: 10.1007/s00232-018-0025-z, PMID: 29516109, PMCID: PMC5910520 [dostęp 2024-05-10] (ang.).
- ↑ Marta Palusińska-Szysz i inni, The human LL-37 peptide exerts antimicrobial activity against Legionella micdadei interacting with membrane phospholipids, „Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids”, 1867 (6), 2022, s. 159138, DOI: 10.1016/j.bbalip.2022.159138 [dostęp 2024-05-10] (ang.).
- 1 2 3 Katarzyna Pastuszak i inni, Susceptibility of Legionella gormanii Membrane-Derived Phospholipids to the Peptide Action of Antimicrobial LL-37—Langmuir Monolayer Studies, „Molecules”, 29 (7), 2024, s. 1522, DOI: 10.3390/molecules29071522, PMID: 38611802, PMCID: PMC11013288 [dostęp 2024-05-10] (ang.).
- 1 2 Marta Majewska i inni, Interaction of LL-37 human cathelicidin peptide with a model microbial-like lipid membrane, „Bioelectrochemistry”, 141, 2021, s. 107842, DOI: 10.1016/j.bioelechem.2021.107842 [dostęp 2024-05-10] (ang.).
- 1 2 3 Monika Rojewska i inni, Langmuir Monolayer Techniques for the Investigation of Model Bacterial Membranes and Antibiotic Biodegradation Mechanisms, „Membranes”, 11 (9), 2021, s. 707, DOI: 10.3390/membranes11090707, PMID: 34564524, PMCID: PMC8471293 [dostęp 2024-05-10] (ang.).
- ↑ Zeinab Mohamed i inni, Clinically Relevant Bacterial Outer Membrane Models for Antibiotic Screening Applications, „ACS Infectious Diseases”, 7 (9), 2021, s. 2707–2722, DOI: 10.1021/acsinfecdis.1c00217 [dostęp 2024-05-10] (ang.).
- 1 2 3 4 5 Rhoderick E. Brown, Howard L. Brockman, Using Monomolecular Films to Characterize Lipid Lateral Interactions, t. 398, Totowa, NJ: Humana Press, 2007, s. 41–58, DOI: 10.1007/978-1-59745-513-8_5, ISBN 978-1-58829-729-7, PMID: 18214373, PMCID: PMC2612596.
- 1 2 3 Vladimir M. Kaganer, Helmuth Möhwald, Pulak Dutta, Structure and phase transitions in Langmuir monolayers, „Reviews of Modern Physics”, 71 (3), 1999, s. 779–819, DOI: 10.1103/RevModPhys.71.779 [dostęp 2024-05-10] (ang.).
- 1 2 Frances Neville i inni, Lipid Headgroup Discrimination by Antimicrobial Peptide LL-37: Insight into Mechanism of Action, „Biophysical Journal”, 90 (4), 2006, s. 1275–1287, DOI: 10.1529/biophysj.105.067595, PMID: 16299073, PMCID: PMC1367279 [dostęp 2024-05-10] (ang.).
- ↑ Małgorzata Jurak i inni, Analysis of Molecular Interactions between Components in Phospholipid-Immunosuppressant-Antioxidant Mixed Langmuir Films, „Langmuir”, 37 (18), 2021, s. 5601–5616, DOI: 10.1021/acs.langmuir.1c00434, PMID: 33915045, PMCID: PMC8280729 [dostęp 2024-05-10] (ang.).
- ↑ Katarzyna Pastuszak i inni, Physicochemical Characteristics of Model Membranes Composed of Legionella gormanii Lipids, „Membranes”, 13 (3), 2023, s. 356, DOI: 10.3390/membranes13030356, PMID: 36984743, PMCID: PMC10058700 [dostęp 2024-05-10] (ang.).
- ↑ David L. Schwinke, M.G. Ganesan, N.D. Weiner, Monolayer Studies of Insulin–Lipid Interactions, „Journal of Pharmaceutical Sciences”, 72 (3), 1983, s. 244–248, DOI: 10.1002/jps.2600720311, PMID: 6341537 [dostęp 2024-04-29] (ang.).
- 1 2 3 4 Régine Maget-Dana, The monolayer technique: a potent tool for studying the interfacial properties of antimicrobial and membrane-lytic peptides and their interactions with lipid membranes, „Biochimica et Biophysica Acta (BBA) - Biomembranes”, 1462 (1-2), 1999, s. 109–140, DOI: 10.1016/S0005-2736(99)00203-5 [dostęp 2024-04-24] (ang.).
- 1 2 Katarzyna Pastuszak i inni, Insight into the Mechanism of Interactions between the LL-37 Peptide and Model Membranes of Legionella gormanii Bacteria, „International Journal of Molecular Sciences”, 24 (15), 2023, s. 12039, DOI: 10.3390/ijms241512039, PMID: 37569419, PMCID: PMC10418352 [dostęp 2024-04-24] (ang.).
- ↑ Michalakis Savva, Balasubramanian Sivakumar, Bilge Selvi, The conventional Langmuir trough technique as a convenient means to determine the solubility of sparingly soluble surface-active molecules: Case study Cholesterol, „Colloids and Surfaces A: Physicochemical and Engineering Aspects”, 325 (1-2), 2008, s. 1–6, DOI: 10.1016/j.colsurfa.2008.04.025, PMID: 19609337, PMCID: PMC2630220 [dostęp 2024-04-29] (ang.).
- ↑ Wanda Barzyk, Ewa Rogalska, Katarzyna Więcław-Czapla, Penetration of Milk-Derived Antimicrobial Peptides into Phospholipid Monolayers as Model Biomembranes, „Biochemistry Research International”, 2013, 2013, s. 1–16, DOI: 10.1155/2013/914540, PMID: 24455264, PMCID: PMC3877611 [dostęp 2024-04-24] (ang.).
- ↑ E. Sevcsik i inni, Interaction of LL-37 with Model Membrane Systems of Different Complexity: Influence of the Lipid Matrix, „Biophysical Journal”, 94 (12), 2008, s. 4688–4699, DOI: 10.1529/biophysj.107.123620, PMID: 18326643, PMCID: PMC2397346 [dostęp 2024-04-29] (ang.).