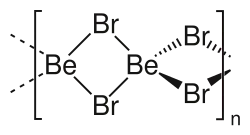
Bromek berylu
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny |
BeBr2 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
168,82 g/mol | ||||||||||||||||||||||||
| Wygląd |
higroskopijne[1] białe lub bezbarwne kryształy[2] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||
| Inne kationy |
MgBr | ||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
Bromek berylu, BeBr
2 – nieorganiczny związek chemiczny z grupy bromków, zawierający beryl na II stopniu utlenienia. Został otrzymany po raz pierwszy w 1828 roku przez Friedricha Wöhlera[2].
Otrzymywanie
Można go otrzymać przez reakcję metalicznego berylu z bromem w temperaturze 500-700 °C[2][3]:
- Be + Br
2 → BeBr
2
Lub poprzez reakcję tlenku berylu z bromowodorem w roztworze wodnym[2]:
- BeO + 2HBr → BeBr
2 + H
2O↑
Zastosowanie
Nie ma praktycznego zastosowania[4].
Przypisy
- 1 2 3 4 5 6 CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-51, ISBN 978-1-4987-5429-3 (ang.).
- 1 2 3 4 5 6 7 8 9 R.C. Ropp, Encyclopedia of the Alkaline Earth Compounds, Elsevier, 2013, s. 40–41, DOI: 10.1016/c2012-0-00777-6, ISBN 978-0-444-59550-8 (ang.).
- 1 2 3 4 5 Dale Perry, Handbook of Inorganic Compounds, wyd. 2, CRC Press, 10 maja 2011, s. 61, DOI: 10.1201/b10908, ISBN 978-1-4398-1461-1 [dostęp 2019-08-24] (ang.).
- ↑ Berylim Halides, [w:] Kenneth Walsh, Beryllium Chemistry and Processing, ASM International, 118), ISBN 978-0-87170-721-5 (ang.).