Undekafluorodiantymonian trifluoroksenonu
| |||||||||||||
| |||||||||||||
| Ogólne informacje | |||||||||||||
| Wzór sumaryczny |
XeF | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
[XeF | ||||||||||||
| Masa molowa |
640,79 g/mol | ||||||||||||
| Wygląd |
jasnożółtozielone kryształy | ||||||||||||
| Identyfikacja | |||||||||||||
| Numer CAS | |||||||||||||
| |||||||||||||
| |||||||||||||
| Podobne związki | |||||||||||||
| Podobne związki | |||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||
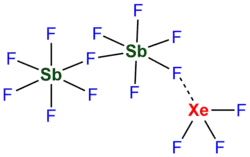
Undekafluorodiantymonian trifluoroksenonu, [XeF
3]+
[Sb
2F
11]−
– nieorganiczny związek chemiczny ksenonu na IV stopniu utlenienia z fluorem i antymonem. Ma on charakter soli, w której kationem jest [XeF
3]+
, a anionem [Sb
2F
11]−
.
Historia
Po przeprowadzeniu kilku udanych syntez heksafluorków metali z ksenonem i otrzymaniu XePtF
6[2], XeRhF
6[3] i XeRuF
6[4], okazało się, że tą metodą można otrzymać pochodne ksenonu tylko z nielicznymi metalami – pozostałe albo nie tworzą heksafluorków, albo ich potencjał utleniający jest zbyt niski[5].
W celu otrzymania nowych kompleksów lub soli ksenonu, na początku lat 60. XX w. podjęto badania nad reakcjami jego fluorków (XeF
2, XeF
4 i XeF
6) z pentafluorkiem antymonu (SbF
5). W przypadku XeF
2 stosunkowo łatwo otrzymano żółty krystaliczny undekafluorodiantymonian fluoroksenonu, [XeF][Sb
2F
11] lub XeF
2·2SbF
5 – po rozpuszczeniu XeF
4 w nadmiarze SbF
5 zaobserwowano wydzielanie gazu i zamiast oczekiwanego związku ksenonu(IV), po odparowaniu wyizolowano właśnie XeF
2·2SbF
5[6] (późniejsze badania wykazały, że obserwowany XeF
2·2SbF
5 był wynikiem zanieczyszczenia XeF
4 difluorkiem (XeF
2), a w przypadku pracy z czystymi związkami produkt ten nie powstawał[7]). W roku 1966 B. Cohen i R.D. Peacock podczas powtarzania tej procedury w łagodniejszych warunkach (ostrożne odparowanie SbF
5 w temperaturze poniżej 25 °C), obok żółtego kompleksu ksenonu(II) uzyskali biały proszek, który na podstawie widma 19
F-NMR zidentyfikowali wstępnie jako XeF
4·2SbF
5[8]. W przeciwieństwie do licznych kompleksów XeF
2 z pentafluorkami metali (oprócz 4 kompleksów z SbF
5 opisane były także różne kompleksy z AsF
5, TaF
5, NbF
5, RuF
5 i OsF
5)[7], a także kilku analogicznych kompleksów XeF
6[9], do końca lat 60. publikacja Cohena i Peacocka była jedynym doniesieniem opisującym domniemany XeF
4·2SbF
5[7]. Otrzymana substancja nie została jednak wyizolowana w stanie czystym i w pełni scharakteryzowana[8][10][11]. Dopiero w roku 1971 grupa R.J. Gillespiego uzyskała związek XeF
4 z SbF
5 w formie czystej i udowodniła jego skład oraz budowę[9][11].
Otrzymywanie i właściwości
Undekafluorodiantymonian trifluoroksenonu można otrzymać w wyniku rozpuszczenia czystego tetrafluorku ksenonu w pentafluorku antymonu w temperaturze 50 °C:
- XeF
4 + 2SbF
5 → [XeF
3][Sb
2F
11]
Po odparowaniu SbF
5 pod zmniejszonym ciśnieniem produkt wytrąca się w postaci żółtych lub jasnożółtozielonych kryształów[9][12], topiących się w temperaturze 81–83 °C[12].
Widma Ramana i 19
F-NMR wykazały, że produkt ma budowę soli [XeF
3][Sb
2F
11][9][12]. Zostało to później potwierdzone badaniami krystalograficznymi, na podstawie których określono, że długość wiązania mostkowego Sb−F−Xe wynosi 2,49 Å i jest znacząco większa niż długości wiązań niemostkowych F−Xe (1,83–1,91 Å). Jednocześnie jest ona wyraźnie krótsza od sumy promieni van der Waalsa Xe i F (3,63 Å), wskazując na znaczący udział wiązania kowalencyjnego między atomem Xe i mostkowym atomem F[11].
W wyniku stapiania [XeF
3]+
[SbF
6]−
z nadmiarem XeF
4 w temperaturze 80 °C powstaje addukt o stosunku składników 1:1[11]:
- XeF
4 + [XeF
3][Sb
2F
11] → 2[XeF
3][SbF
6]
Pomimo problemów napotkanych w latach 60., w toku późniejszych badań w reakcjach XeF
4 z BiF
5 i AsF
5 otrzymano także inne związki zawierające kationy [XeF
3]+
[11].
Przypisy
- 1 2 CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 4-99, ISBN 978-0-8493-0488-0 (ang.).
- ↑ Neil Bartlett, Xenon hexafluoroplatinate(V) Xe+[PtF6]−, „Proceedings of the Chemical Society”, 6, 1962, s. 218, DOI: 10.1039/PS9620000197.
- ↑ C.L. Chernick i inni, Fluorine Compounds of Xenon and Radon, „Science”, 138 (3537), 1962, s. 136–138, DOI: 10.1126/science.138.3537.136.
- ↑ H.H. Hyman, Noble Gas Compounds, Chicago: Chicago University Press, 1963, s. 23–30.
- ↑ Farhad Tamadon, Stefan Seidel, Seppelt Konrad, Reactions of Xenon with Iridiumand Osmiumhexafluoride, „Acta Chimica Slovenica”, 60, 2013, s. 491–494, PMID: 24169702, OCLC 52113051.
- ↑ A.J. Edwards, J.H. Holloway, R.D. Peacock, New Fluorine Compounds of Xenon, „Proceedings of the Chemical Society”, 1963, s. 275–276, DOI: 10.1039/PS9630000253.
- 1 2 3 John H. Holloway, James G. Knowles, Reactions of xenon difluoride with the pentafluorides of tantalum, niobium, ruthenium, and osmium, „Journal of the Chemical Society A: Inorganic, Physical, Theoretical”, 1969, s. 756–761, DOI: 10.1039/J19690000756.
- 1 2 B. Cohen, R.D Peacock, Properties of xenon fluoride adducts, „Journal of Inorganic and Nuclear Chemistry”, 28 (12), 1966, s. 3056–3057, DOI: 10.1016/0022-1902(66)80037-4.
- 1 2 3 4 R.J. Gillespie, B. Landa, G.J. Schrobilgen, Trifluoroxenon(IV)[small micro]-fluoro-bispentafluoroantimonate(V): the XeF3+ cation, „Journal of the Chemical Society D: Chemical Communications”, 23, 1971, s. 1543–1544, DOI: 10.1039/C29710001543.
- ↑ Neil Bartlett, F.O. Sladky, The relative fluoride ion donor abilities of XeF2, XeF4, and XeF6 and a chemical purification of XeF4, „Journal of the American Chemical Society”, 90 (19), 1968, s. 5316–5317, DOI: 10.1021/ja01021a072. Reprint: Neil Bartlett, The Oxidation of Oxygen and Related Chemistry. Selected Papers of Neil Bartlett, Singapur: World Scientific Publishing, 2001, s. 185, ISBN 981-02-2775-2.
- 1 2 3 4 5 Jamie Haner, Gary J. Schrobilgen, The Chemistry of Xenon(IV), „Chemical Reviews”, 115 (2), 2015, s. 1255–1295, DOI: 10.1021/cr500427p.
- 1 2 3 D.E. McKee, C.J. Adams, Neil Bartlett, Preparation and Raman spectra of the salts [XeF3+][SbF6−], [XeF3+][Sb2F11−], [XeOF3+][SbF6−] and [XeOF3+][Sb2F11−], „Inorganic Chemistry”, 12 (8), 1973, s. 1722–1725, DOI: 10.1021/ic50126a003.