Pentafluorek arsenu
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||
| Wzór sumaryczny |
AsF5 | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
169,91 g/mol | |||||||||||||||||||||||||||
| Wygląd |
bezbarwny gaz[1] | |||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||
| Numer CAS | ||||||||||||||||||||||||||||
| PubChem | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||
| Inne aniony |
AsCl | |||||||||||||||||||||||||||
| Inne kationy |
PF | |||||||||||||||||||||||||||
| Podobne związki |
AsF | |||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||
Pentafluorek arsenu, nazwa Stocka: fluorek arsenu(V), AsF
5 – nieorganiczny związek chemiczny z grupy fluorków, sól kwasu fluorowodorowego i arsenu na V stopniu utlenienia.
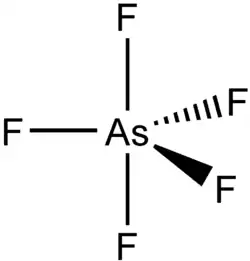
Budowa cząsteczki
Pentafluorek arsenu jest związkiem o budowie bipiramidy trygonalnej[4]. Długość aksjalnych wiązań As−F wynosi 171,9 pm, natomiast wiązań ekwatorialnych – 168,8 pm[3].
Otrzymywanie
Pentafluorek arsenu może zostać otrzymany poprzez ogrzewanie arsenu z fluorem[3][6]:
- 2As + 5F
2 → 2AsF
5
Inną metodą jest reakcja fluoru z tritlenkiem diarsenu[3].
Właściwości
Pentafluorek arsenu jest bezbarwnym gazem, rozpuszczalnym w etanolu, benzenie i eterze dietylowym, natomiast reagującym z wodą[1]. Jest silnym utleniaczem i kwasem Lewisa[3].
W rozpuszczalniku freonowym i w obecności pentafluorku arsenu, trimer chlorocyjanu (CNCl)
3 reaguje z fluorem dając kompleks [C
3N
3Cl
3F][AsF
6][6]. Pod ciśnieniem w niskich temperaturach i w nadfiolecie, pentafluorek arsenu reaguje z trifluorkiem azotu i fluorem tworząc heksafluoroarsenian tetrafluoroamonu[6]:
- NF
3 + F
2 + AsF
5 → NF
4AsF
6
W niskich temperaturach w wyniku reakcji pomiędzy tribromkiem arsenu, bromem i pentafluorkiem arsenu tworzy się kompleks [AsBr
4]+
[AsF
6]−
. Z pentachlorkiem antymonu tworzy natomiast mieszany halogenek SbCl
4F występujący jako tetramer[3].
Przypisy
- 1 2 3 4 5 6 7 David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-49, ISBN 978-1-4200-9084-0 (ang.).
- 1 2 3 4 Arsenic pentafluoride, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 500011 [dostęp 2023-08-22] (niem. • ang.).
- 1 2 3 4 5 6 7 8 Norman N. Greenwood, Alan Earnshaw, Chemistry of the Elements, wyd. 2, Oxford–Boston: Butterworth-Heinemann, 1997, s. 561–563, ISBN 0-7506-3365-4 (ang.).
- 1 2 Adam Bielański, Podstawy chemii nieorganicznej, wyd. 6, t. 1–2, Warszawa: Wydawnictwo Naukowe PWN, 2010, s. 682, ISBN 978-83-01-16283-2.
- ↑ Arsenic Pentafluoride [online], karta charakterystyki produktu Matheson Tri-Gas, 11 grudnia 2008, numer katalogowy: MAT02015 [zarchiwizowane z adresu 2017-12-08] (ang.).
- 1 2 3 Pradyot Patnaik, Handbook of Inorganic Chemicals, London: McGraw-Hill, 2003, s. 63, 286, 656, ISBN 0-07-049439-8 (ang.).