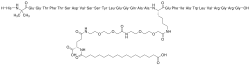
Semaglutyd
| |||||
| Ogólne informacje | |||||
| Wzór sumaryczny |
C187H291N45O59 | ||||
|---|---|---|---|---|---|
| Masa molowa |
4113,64 g/mol | ||||
| Identyfikacja | |||||
| Numer CAS | |||||
| PubChem | |||||
| DrugBank | |||||
| |||||
| |||||
| Klasyfikacja medyczna | |||||
| ATC | |||||
Semaglutyd – organiczny związek chemiczny z grupy analogów peptydów, stosowany w leczeniu cukrzycy typu 2 i otyłości[1].
Został opracowany przez firmę Novo Nordisk (tworzony w zespole Lotte Bjere Knudsen[2]) w 2012 roku i dopuszczony do stosowania w USA w 2017 roku[3].
Obszary działania semaglutydu
Semaglutyd jest analogiem ludzkiego peptydu glukagonopodobnego 1 (GLP-1) o sekwencji w 94% homologicznej z hormonem ludzkim. Łączy się z receptorami GLP-1 i wykazuje podobne działanie[4]. Nasila sekrecję insuliny wywołaną hiperglikemią, hamując jednocześnie sekrecję glukagonu. Dodatkowo nieznacznie spowalnia opróżnianie żołądka, co zapobiega dużemu wzrostowi glikemii po posiłku, równocześnie zmniejszając ilości spożywanych kalorii[5][6][4].
Ponadto semaglutyd wykazuje działanie ochronne na układ sercowo-naczyniowy. Mechanizm ten jest prawdopodobnie wieloczynnikowy – wynika ze zmniejszenia ilości tkanki tłuszczowej oraz z wpływu na znane czynniki ryzyka sercowo-naczyniowego (zmniejszenie ciśnienia krwi, korzystny wpływ na profil lipidowy i metabolizm glukozy oraz działanie przeciwzapalne odzwierciedlone w zmniejszeniu stężenia białka C-reaktywnego o wysokiej czułości. Dokładny mechanizm zmniejszający ryzyko sercowo – naczyniowe nie został ustalony[7][8][9].
Zastosowanie


Semaglutyd jest stosowany w leczeniu cukrzycy typu 2 oraz kontroli masy ciała w nadwadze i otyłości[1].
Redukcja masy ciała
W przebiegu badań STEP potwierdzono bezpieczeństwo oraz wysoką skuteczność redukcji masy ciała[4];
Redukcja ryzyka sercowo-naczyniowego
Wyniki badań SELECT, SOUL oraz SUSTAIN 6 potwierdziły bezpieczeństwo sercowo-naczyniowe w różnych populacjach pacjentów oraz wykazały istotne zmniejszenie ryzyka wystąpienia poważnych epizodów sercowo-naczyniowych[7][8][9];
Działania niepożądane
Do najczęstszych działań niepożądanych stosowania semaglutydu należą nudności, wymioty, biegunka oraz bóle i wzdęcia. W rzadkich przypadkach mogą wystąpić reakcje alergiczne, opóźnione opróżnianie żołądka oraz zapalenie trzustki[2][4];
Preparaty
Preparaty dostępne w Polsce (2024)[10]:
- Ozempic – roztwór do wstrzykiwań
- Rybelsus – tabletki
- Wegovy – roztwór do wstrzykiwań
Przypisy
- 1 2 Gurdeep Singh, Matthew Krauthamer, Meghan Bjalme-Evans, Wegovy (Semaglutide): A New Weight Loss Drug for Chronic Weight Management, „Journal of Investigative Medicine”, 70 (1), 2022, s. 5–13, DOI: 10.1136/jim-2021-001952, PMID: 34706925, PMCID: PMC8717485 [dostęp 2025-04-22] (ang.).
- 1 2 Lotte Bjerre Knudsen [online].
- ↑ Ozempic (semaglutide) approved in the US [online], Novo Nordisk, 5 grudnia 2017 (ang.).
- 1 2 3 4 Wegovy. Charakterystyka Produktu Leczniczego [online], 2022; aktualizacja 2024, Novo Nordisk [dostęp 2025-04-22].
- ↑ T.D. Müller i inni, Glucagon-like peptide 1 (GLP-1), „Molecular Metabolism”, 30, 2019, s. 72–130, DOI: 10.1016/j.molmet.2019.09.010, PMID: 31767182, PMCID: PMC6812410 [dostęp 2025-04-22] (ang.).
- ↑ Michael A. Nauck i inni, GLP-1 receptor agonists in the treatment of type 2 diabetes – state-of-the-art, „Molecular Metabolism”, 46, 2021, s. 101102, DOI: 10.1016/j.molmet.2020.101102, PMID: 33068776, PMCID: PMC8085572 [dostęp 2025-04-22] (ang.).
- 1 2 Darren K. McGuire i inni, Oral Semaglutide and Cardiovascular Outcomes in High-Risk Type 2 Diabetes, „The New England Journal of Medicine”, 2025, DOI: 10.1056/NEJMoa2501006 [dostęp 2025-04-22] (ang.).
- 1 2 A. Michael Lincoff i inni, Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes, „The New England Journal of Medicine”, 389 (24), 2023, s. 2221–2232, DOI: 10.1056/NEJMoa2307563 [dostęp 2025-04-22] (ang.).
- 1 2 Steven P. Marso i inni, Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes, „The New England Journal of Medicine”, 375 (19), 2016, s. 1834–1844, DOI: 10.1056/NEJMoa1607141 [dostęp 2025-04-22] (ang.).
- ↑ Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 20 grudnia 2024 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej [online], DZ. URZ. Min. Zdr. 2024.141, 20 grudnia 2024 [dostęp 2025-04-22].
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.