Treonina
| |||||||||||||
| |||||||||||||
| Ogólne informacje | |||||||||||||
| Wzór sumaryczny |
C4H9NO3 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
119,12 g/mol | ||||||||||||
| Wygląd |
bezbarwne ciało stałe | ||||||||||||
| Identyfikacja | |||||||||||||
| Numer CAS |
72-19-5 (L-treonina) | ||||||||||||
| PubChem | |||||||||||||
| DrugBank | |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||
Treonina, kwas α-amino-β-hydroksymasłowy, skr. Thr lub T – organiczny związek chemiczny z grupy aminokwasów. Stereoizomer L jest jednym z podstawowych aminokwasów białkowych. Należy do aminokwasów niezbędnych (nie może być syntetyzowany w organizmie człowieka i musi być dostarczany z pożywieniem). Produkty o dużej zawartości treoniny to twaróg, drób, ryby, mięso, soczewica, i ziarno sezamowe.
Stereochemia
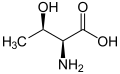
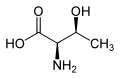
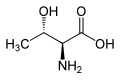
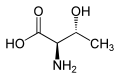
Treonina zawiera dwa centra stereogeniczne: standardowy asymetryczny atom węgla α oraz atom węgla β. W efekcie występują 4 stereoizomery tego aminokwasu. Podstawowym aminokwasem białkowym jest L-treonina o konfiguracji absolutnej 2S,3R[4]. Inne izomery zostały wykryte jako składniki aktywnych biologicznie związków naturalnych, takich jak falloidyna i falloina (D-Thr)[4]; astyna, globomycyna, lizobaktyna[5] i telomycyna[6] (L-aThr); wiskozyna[7], glikolipidy i peptydolipidy wytwarzane przez prątki i bakterie z klasy Actinomycetes[6] (D-aThr).
 |
 |
| L-Treonina (2S,3R) L-Thr |
D-Treonina (2R,3S) D-Thr |
 |
 |
| L-allo-Treonina (2S,3S) L-aThr |
D-allo-Treonina (2R,3R) D-aThr |
L-Thr i D-Thr oraz L-aThr i D-aThr stanowią pary enancjomerów, natomiast L-Thr i L-aThr oraz D-Thr i D-aThr są parami diastereoizomerów[4][6].
Drugim podstawowym aminokwasem białkowym, który ma diastereoizomery allo jest izoleucyna[9].
Przypisy
- ↑ L-Threonine, [w:] PubChem [online], United States National Library of Medicine, CID: 6288 (ang.).
- ↑ Threonine, [w:] DrugBank [online], University of Alberta, DB00156 (ang.).
- ↑ L-Threonine [online], karta charakterystyki produktu Sigma-Aldrich, 11 stycznia 2025, numer katalogowy: T8625 [dostęp 2025-04-08]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- 1 2 3 threonine, [w:] Richard Cammack i inni red., Oxford Dictionary of Biochemistry and Molecular Biology, wyd. 2, Oxford: Oxford University Press, 2008, s. 661–662, ISBN 978-0-19-172764-1 (ang.).
- ↑ Brooke A. Johnson i inni, Expanding the Landscape of Noncanonical Amino Acids in RiPP Biosynthesis, „Journal of the American Chemical Society”, 146 (6), 2024, s. 3805–3815, DOI: 10.1021/jacs.3c10824 (ang.).
- 1 2 3 allothreonine, [w:] Richard Cammack i inni red., Oxford Dictionary of Biochemistry and Molecular Biology, wyd. 2, Oxford: Oxford University Press, 2008, s. 30, ISBN 978-0-19-172764-1 (ang.).
- ↑ Terrence R. Burke i inni, Solid-phase synthesis of viscosin, a cyclic depsipeptide with antibacterial and antiviral properties, „Tetrahedron Letters”, 30 (5), 1989, s. 519–522, DOI: 10.1016/S0040-4039(00)95242-0 (ang.).
- ↑ Peter Wipf, Chris P. Miller, Stereospecific synthesis of peptide analogs with allo-threonine and D-allo-threonine residues, „Journal of Organic Chemistry”, 58 (6), 1993, s. 1575–1578, DOI: 10.1021/jo00058a047 (ang.).
- 1 2 Nomenclature and symbolism for amino acids and peptides (Recommendations 1983), „Pure and Applied Chemistry”, 56 (5), 1984, s. 595–624, DOI: 10.1351/pac198456050595 (ang.).