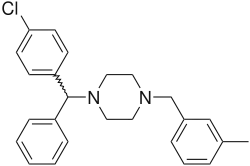
Meklizyna
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny |
C25H27ClN2 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
390,95 g/mol | ||||||||||||||||||||||||||
| Wygląd |
krystaliczne ciało stałe[1] | ||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||
| Stosowanie w ciąży |
kategoria B | ||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
Meklizyna, meklozyna – organiczny związek chemiczny z grupy pochodnych piperazyny, stosowany jako lek przeciwhistaminowy w leczeniu choroby lokomocyjnej i zawrotów głowy[3]. W niektórych krajach meklizyna jest dostępna bez recepty (OTC)[4], w Australii[5] oraz w Polsce nie jest w ogóle dostępna. Efekty jej działania pojawiają się po godzinie i trwają około jednej doby. Do jej najczęstszych efektów ubocznych zalicza się ospałość, a także suchość w ustach[3].
Meklizyna została opatentowana w 1951 roku. Dwa lata później weszła do użytku medycznego[6]. W 2019 roku była 161. najczęściej przepisywanym lekarstwem w Stanach Zjednoczonych (ponad 3,8 miliona razy)[7].
Otrzymywanie
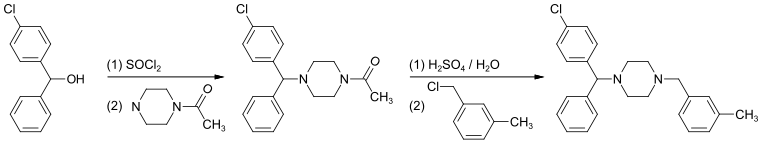
Związek ten można otrzymać poprzez halogenowanie (4-chlorofenylo)-fenylometanolu chlorkiem tionylu przed dodaniem acetylopiperazyny. Następnie dochodzi do odłączenia grupy acetylowej przy użyciu rozcieńczonego kwasu siarkowego. Ostatnią reakcją w tej syntezie jest N-alkilowanie pierścienia piperazynowego chlorkiem 3-metylobenzylu[8]:
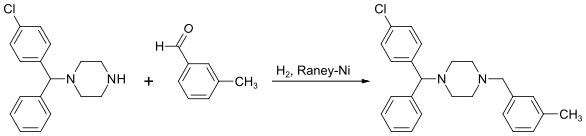
Alternatywnie, ostatni etap powyższej syntezy może zostać zastąpiony przez N-alkilowanie aldehydu 3-metylobenzoesowego. Czynnikiem redukującym w tej reakcji jest wodór, natomiast katalizatorem – nikiel Raneya[9]:
Przypisy
- 1 2 3 4 5 Karta charakterystyki: dane zewnętrzne firmy Cayman Chemical [dostęp: 2019-12-30]
- ↑ Meclizine, [w:] DrugBank [online], University of Alberta, DB00737 (ang.).
- 1 2 3 Meclizine Hydrochloride [online], Drugs.com [dostęp 2019-12-31] (ang.).
- ↑ M. Cappa i inni, Advanced Therapies in Pediatric Endocrinology and Diabetology, Karger Medical and Scientific Publishers, 2015, s. 101, ISBN 978-3-318-05637-2 (ang.).
- ↑ Gayle McKenzie i inni, Pharmacology in Nursing: Australian and New Zealand Edition with Student Resource Access 12 Months, Cengage AU, 2016, s. 569, ISBN 978-0-17-036203-0 (ang.).
- ↑ János Fischer, C. Robin Ganellin, Analogue-based Drug Discovery, John Wiley & Sons, 2006, s. 547, ISBN 978-3-527-60749-5 (ang.).
- ↑ Top 300 Drugs [online], ClinCalc.com, 31 grudnia 2019 [dostęp 2020-01-01].
- ↑ Jürgen-Hinrich Fuhrhop, Guangtao Li, E.J. Corey, Organic Synthesis: Concepts and Methods, 3rd, Completely Revised and Enlarged Edition, Wiley, 2003, s. 237, ISBN 978-3-527-30272-7.
- ↑ Kleemann A i inni, Pharmaceutical Substances. Synthesis, Patents, Applications (4th ed.), Thieme, 2001, ISBN 3-13-115134-X.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.