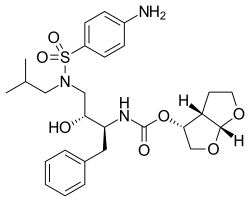
Darunawir
| ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C27H37N3O7S | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
547,67 g/mol | |||||||||||||||||||||||||||||
| Wygląd |
białe bezpostaciowe ciało stało[1] | |||||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||||
| Numer CAS |
206361-99-1 | |||||||||||||||||||||||||||||
| PubChem | ||||||||||||||||||||||||||||||
| DrugBank | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | ||||||||||||||||||||||||||||||
| ATC | ||||||||||||||||||||||||||||||
| Stosowanie w ciąży |
kategoria B[3] | |||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
Darunawir (łac. darunavirum) – wielofunkcyjny organiczny związek chemiczny, inhibitor proteaz, lek stosowany w leczeniu zakażeń ludzkim wirusem niedoboru odporności.
Mechanizm działania
Darunawir poprzez zablokowanie proteazy HIV-1 powoduje uwalnianie niedojrzałych postaci ludzkiego wirusa niedoboru odporności, które są niezakaźne[3].
Zastosowanie
Jest przeznaczony do leczenia zakażeń ludzkim wirusem niedoboru odporności (HIV-1) jednocześnie z innymi przeciwretrowirusowymi produktami leczniczymi u dorosłych pacjentów wcześniej intensywnie leczonych lekami przeciwretrowirusowymi, u których leczenie z użyciem więcej niż jednego schematu leczenia zawierającego inhibitor proteazy (PI) nie przyniosło rezultatów. Jest stosowany wyłącznie w połączeniu z rytonawirem[4].
Znajduje się na wzorcowej liście podstawowych leków Światowej Organizacji Zdrowia (WHO Model Lists of Essential Medicines) (2017)[5].
Jest dopuszczony do obrotu w Polsce (2018)[6].
Działania niepożądane
Może powodować następujące działania niepożądane u ponad 1% pacjentów: ból głowy, wymioty, biegunka, nudności, ból brzucha, zwiększona aktywność amylazy we krwi, wysypka, zmęczenie, zwiększenie aktywności enzymów wątrobowych, hiperlipidemia[4].
Przypisy
- 1 2 3 4 Darunavir, [w:] PubChem [online], United States National Library of Medicine, CID: 213039 (ang.).
- ↑ Darunavir SC-218079. Santa Cruz Biotechnology. [dostęp 2018-06-21]. (ang.).
- 1 2 3 4 5 6 Jan K. Podlewski, Alicja Chwalibogowska-Podlewska: Leki współczesnej terapii. T. 1. Warszawa: Medical Tribune, 2010, s. 189-190. ISBN 978-83-60135-94-5.
- 1 2 Janssen-Cilag: Prezista 300 mg tabletki powlekane. Charakterystyka Produktu Leczniczego. Europejska Agencja Leków, 2008. [dostęp 2018-06-21].
- ↑ WHO Model List of Essential Medicines 20th List. Światowa Organizacja Zdrowia, 2017. s. 20. [dostęp 2018-06-21]. (ang.).
- ↑ Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 16 kwietnia 2018 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej. Dziennik Urzędowy Ministra Zdrowia, 2018-04-16. [dostęp 2018-06-21].
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.