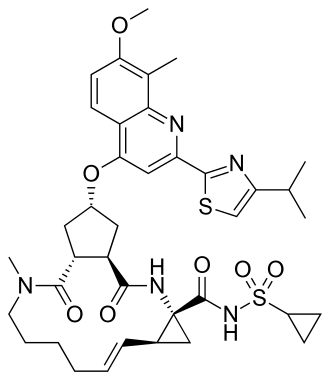
Symeprewir
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny |
C38H47N5O7S2 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
749,94 g/mol | ||||||||||||||||||||||||||||
| Wygląd |
białe lub prawie biały proszek | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||
| Stosowanie w ciąży |
kategoria C[3] | ||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
Symeprewir (łac. simeprevirum) – wielofunkcyjny makrocykliczny organiczny związek chemiczny stosowany jako inhibitor proteazy serynowej w leczeniu wirusowego zapalenia wątroby typu C w skojarzeniu z innymi lekami przeciwwirusowymi.
Mechanizm działania
Poprzez wybiórczne i odwracalne blokowanie miejsca aktywnego proteazy serynowej NS3/4A zakłóca hydrolizę poliproteiny wirusa zapalenia wątroby typu C, co uniemożliwia jego replikację[3][4].
Zastosowanie
- przewlekłe wirusowe zapalenie wątroby typu C u dorosłych w skojarzeniu z innymi lekami przeciwwirusowymi[5]
Znajduje się na wzorcowej liście podstawowych leków Światowej Organizacji Zdrowia (WHO Model Lists of Essential Medicines) (2017)[6].
Jest dopuszczony do obrotu w Polsce (2018)[7].
Działania niepożądane
Nie są znane działania uboczne symeprewiru w monoterapii, natomiast jego działaniami ubocznymi w terapii skojarzonej z rybawiryną, z rybawiryną i sofosbuwirem oraz z rybawiryną i peginterferonem α występującymi u ponad 5% pacjentów były nudności, wysypka, świąd, duszność, zaparcie, reakcje fotoalergiczne i zwiększenie stężenia bilirubiny w osoczu[5].
Przypisy
- 1 2 Simeprevir, [w:] PubChem [online], United States National Library of Medicine, CID: 24873435 (ang.).
- ↑ Simeprevir SC-473928 Material Safety Data Sheet. Santa Cruz Biotechnology. [dostęp 2018-07-23]. (ang.).
- 1 2 3 4 5 6 7
 Jan K. Podlewski, Alicja Chwalibogowska-Podlewska: Leki współczesnej terapii online. Medical Tribune Polska. [dostęp 2018-07-23].
Jan K. Podlewski, Alicja Chwalibogowska-Podlewska: Leki współczesnej terapii online. Medical Tribune Polska. [dostęp 2018-07-23]. - ↑
 D. Banerjee, KR. Reddy. Review article: safety and tolerability of direct-acting anti-viral agents in the new era of hepatitis C therapy.. „Aliment Pharmacol Ther”. 43 (6), s. 674-96, 2016. DOI: 10.1111/apt.13514. PMID: 26787287.
D. Banerjee, KR. Reddy. Review article: safety and tolerability of direct-acting anti-viral agents in the new era of hepatitis C therapy.. „Aliment Pharmacol Ther”. 43 (6), s. 674-96, 2016. DOI: 10.1111/apt.13514. PMID: 26787287. - 1 2 Janssen-Cilag: Olysio 150 mg kapsułki twarde. Charakterystyka Produktu Leczniczego. Europejska Agencja Leków, 2014-05-14. [dostęp 2018-07-23].
- ↑ WHO Model List of Essential Medicines 20th List. Światowa Organizacja Zdrowia, 2017. s. 21-22. [dostęp 2018-07-23]. (ang.).
- ↑ Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 16 kwietnia 2018 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej. Dziennik Urzędowy Ministra Zdrowia, 2018-04-16. [dostęp 2018-07-23].
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.