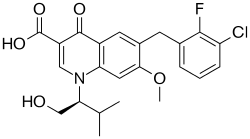
Elwitegrawir
| ||||||||||||||||||||||||
| ||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||
| Wzór sumaryczny |
C23H23ClFNO5 | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
447,88 g/mol | |||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||
| Numer CAS | ||||||||||||||||||||||||
| PubChem | ||||||||||||||||||||||||
| DrugBank | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
| ||||||||||||||||||||||||
| ||||||||||||||||||||||||
| ||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||
| Klasyfikacja medyczna | ||||||||||||||||||||||||
| ATC | ||||||||||||||||||||||||
| Stosowanie w ciąży |
kategoria B[4] | |||||||||||||||||||||||
| ||||||||||||||||||||||||
| ||||||||||||||||||||||||
Elwitegrawir (łac. elvitegravirum) – wielofunkcyjny organiczny związek chemiczny, inhibitor integrazy ludzkiego wirusa niedoboru odporności, stosowany jako lek wzmacniający działanie rytonawiru oraz kobicystatu.
Mechanizm działania
Elwitegrawir hamuje integrazę HIV poprzez wiązanie się z aktywnym miejscem integrazy i blokowanie etapu transferu łańcucha w procesie integracji retrowirusowego kwasu deoksyrybonukleinowego (DNA)[5]. Proces ma kluczowe znaczenie dla cyklu replikacji HIV[6].
Zastosowanie
Stany Zjednoczone
- zakażenie ludzkim wirusem upośledzenia odporności typu 1 (HIV-1) u osób dorosłych leczonych lekami przeciwretrowirusowymi w skojarzeniu z rytonawirem lub z innymi lekami przeciwretrowirusowymi[7].
Elwitegrawir nie jest dopuszczony do obrotu ani w Polsce, ani w Unii Europejskiej (2020)[5][8].
Działania niepożądane
Elwitegrawir może powodować następujące działania niepożądane u ponad 1% pacjentów[5]: biegunka, ból głowy, ból brzucha, nudności, wymioty, wysypka, zmęczenie.
Uwagi
- ↑ Okres półtrwania zależny od podania razem z rytonawirem (9,5 h) lub kobicystatem (14,5 h).
Przypisy
- ↑ Elvitegravir, [w:] DrugBank [online], University of Alberta, DB09101 [dostęp 2020-11-18] (ang.).
- ↑ Elvitegravir [online], karta charakterystyki produktu Sigma-Aldrich, 29 marca 2023, numer katalogowy: SML3672 [dostęp 2023-09-02]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Elvitegravir [online], karta charakterystyki poduktu Santa Cruz Biotechnology, 9 stycznia 2015, numer katalogowy: SC-207615 [dostęp 2020-11-18] (ang.).
- 1 2 Jan Podlewski, Alicja Chwalibogowska-Podlewska, Encyklopedia Leki Współczesnej Terapii, wyd. 22, Warszawa: Medical Tribune Polska, 2019, s. 336, ISBN 978-83-951310-6-6.
- 1 2 3 4 5 6 Vitekta 85 mg tabletki powlekane. Charakterystyka Produktu Leczniczego, Gilead Sciences International Limited, Europejska Agencja Leków [dostęp 2020-11-18].
- ↑ Alfred Zejc, Martia Gorczyca, Chemia leków, Warszawa: Państwowy Zakład Wydawnictw Lekarskich, 2008, s. 418–421, ISBN 978-83-200-3652-7.
- ↑ Vitekta (elvitegravir) tablets, for oral use [online], Agencja Żywności i Leków, 2014 [dostęp 2020-11-18].
- ↑ Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 8 lipca 2020 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej, „Dziennik Urzędowy Ministra Zdrowia”, 20 lipca 2020, Dz. Urz. Min. Zdr. 2020.48.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.