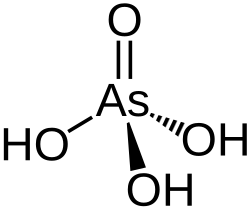
Kwas arsenowy
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny |
H | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
(OH) | ||||||||||||||||||||||||
| Masa molowa |
141,94 g/mol | ||||||||||||||||||||||||
| Wygląd |
bezwodny kwas arsenowy nie daje się wyizolować, hemihydrat ma postać przezroczystych do białych, higroskopijnych, bezwonnych kryształów[1] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Pochodne |
arseniany, np. arsenian sodu | ||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
Kwas arsenowy, nazwa Stocka: kwas arsenowy(V), H
3AsO
4 – nieorganiczny związek chemiczny z grupy kwasów tlenowych. Jest kwasem trójprotonowym o mocy zbliżonej do kwasu fosforowego (pKa 2,26, 6,76 i 11,29[2]). Jest silnie trujący.
Otrzymywanie
Roztwory kwasu arsenowego otrzymać można przez rozpuszczenie bezwodnika arsenowego (pentatlenku diarsenu) w wodzie:
- As
2O
5 + 3H
2O ⇌ 2H
3AsO
4
Poprzez odwodnienie (np. dekatlenkiem tetrafosforu) reakcja ulega odwróceniu. Inną reakcją otrzymywania kwasu arsenowego jest utlenianie arsenu albo tritlenku diarsenu za pomocą stężonego kwasu azotowego:
- As + 5HNO
3 → 5NO
2 + H
2O + H
3AsO
4 - As
2O
3 + 4HNO
3 + H
2O → 4NO
2 + 2H
3AsO
4
Właściwości
Kwas arsenowy jest silnie higroskopijny. W temperaturze −30 °C stabilne są jego dwa hydraty: H
3AsO
4·½H
2O oraz H
3AsO
4·2H
2O. Przy podgrzewaniu do 100 °C powstaje związek o stosunku As
2O
5:H
2O = 3:5. Po przekroczeniu 300 °C powstaje bezwodny As
2O
5. Bezwodny kwas arsenowy nie został dotąd uzyskany.
Przypisy
- 1 2 3 Arsenic acid, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 500006 [dostęp 2025-03-02] (niem. • ang.).
- 1 2 3 4 5 6 7 8 CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-48, 5-87, ISBN 978-1-4987-5429-3 (ang.).