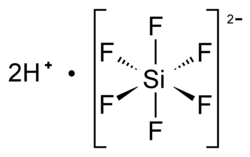
Kwas heksafluorokrzemowy
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
H2[SiF6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
H2SiF6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molowa |
144,09 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
jasnożółta ciecz[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki |
kwas heksafluorofosforowy | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||
Kwas heksafluorokrzemowy – nieorganiczny związek chemiczny krzemu i fluoru; mocny, nietrwały kwas. Może istnieć tylko w roztworach wodnych o maksymalnym stężeniu 61%. Ogrzany lub pod działaniem stężonego kwasu siarkowego rozkłada się na fluorowodór i tetrafluorek krzemu:
- H2SiF6 → 2HF + SiF4
Powstaje w reakcji fluorowodoru z krzemionką:
- SiO2 + 6 HF → H2SiF6 + 2 H2O
Przemysłowo otrzymywany jest z fluorytu[4] oraz jako produkt uboczny podczas produkcji kwasu fosforowego z minerałów zawierających fluor.
Stosowany głównie podczas produkcji aluminium, do przekształcania tlenku glinu w fluorek glinu i kriolit, np.:
- H2SiF6 + Al2O3 → 2 AlF3 + SiO2 + H2O
Sól sodowa (heksafluorokrzemian sodu) jest stosowana jako środek owadobójczy i środek do fluorowania wody.
Przypisy
- ↑ Kwas heksafluorokrzemowy (nr 01302) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2014-12-02]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- 1 2 Kwas heksafluorokrzemowy (nr 01302) w katalogu produktów Sigma-Aldrich (Merck). [dostęp 2014-12-02].
- ↑ Kwas heksafluorokrzemowy (nr 01302) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2014-12-02]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ USGS. Fluorspar.
Bibliografia
- Encyklopedia dla wszystkich. Chemia. Małgorzata Wiśniewska (red.). Warszawa: Wydawnictwa Naukowe i Techniczne, 2001, s. 130. ISBN 83-204-2590-5.