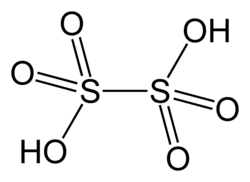
Kwas ditionowy
| |||||||||||||||
| |||||||||||||||
| Ogólne informacje | |||||||||||||||
| Wzór sumaryczny |
H2S2O6 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
162,12 g/mol | ||||||||||||||
| Identyfikacja | |||||||||||||||
| Numer CAS | |||||||||||||||
| PubChem | |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| Podobne związki | |||||||||||||||
| Podobne związki | |||||||||||||||
| Pochodne |
ditioniany (podsiarczany) | ||||||||||||||
Kwas ditionowy, kwas dwutionowy, kwas podsiarkowy – nieorganiczny związek chemiczny z grupy kwasów tlenowych siarki. Jest związkiem nietrwałym, istnieje tylko w rozcieńczonych roztworach. Sole kwasu ditionowego, ditioniany (podsiarczany), otrzymuje się przez utlenianie siarczynów dwutlenkiem manganu w środowisku kwaśnym[1]. Ogrzewanie kwaśnych roztworów dwutionianów prowadzi do ich rozkładu[2]:
Kwas ditionowy jest najprostszym przedstawicielem grupy kwasów politionowych o wzorze ogólnym H
2S
xO
6, gdzie x = od 2 do 6, znanych jedynie w postaci soli[1][2].
Przypisy
- 1 2 Adam Bielański, Chemia ogólna i nieorganiczna, Warszawa: Państwowe Wydawnictwo Naukowe, 1981, s. 394, ISBN 83-01-02626-X.
- 1 2 John David Lee, Zwięzła chemia nieorganiczna, wyd. 4, Warszawa: Wydawnictwo Naukowe PWN, 1997, s. 256–257, ISBN 83-01-12352-4.